在基因治疗领域中近一年发生了不少的与投资有关活动,例如大量的尽职调查、一些投资交易被宣布、还有一些正在进行中并即将对外公布的工作。这些活动反映了风险资金对基因治疗以及开发基因治疗方法的公司越来越感兴趣。
在基因治疗领域中,大多数的投资都是来自于风险资金投资。在2012年11月19号,AGTC(Applied Genetic Technologies Corporation)公司就宣布在B轮融资中获得了3750万美元的投资,从而使得公司可以继续进行α-1 抗胰蛋白缺乏症(Alpha-1 Antitrypsin Deficiency)的II期项目,并全面启动另外两个罕见病——全色盲及X染色体连锁视网膜劈裂(X-Linked Rentinoschisis)——的潜在疗法的研发。
AGTC是一家位于美国佛罗里达州的生物技术公司。AGTC公司利用其独有的、非致病性重组腺病毒载体系统研发新型的基因疗法。AGTC已经证实利用这套系统能够将一份正常的基因整合至动物或人体中,从而机体能够持续产生具有治疗效果的重要的生物产物。α-1抗胰蛋白缺乏症疗法以及雷伯氏先天性黑内障(Leber’s Congenital Amaurosis)是这家公司目前最先进的两个项目,均是利用非致病性重组腺病毒载体系统研发的。
同样是在2012年11月,欧盟委员会(EC)批准了西方世界首个基因治疗药物Glybera,该药来自荷兰生物技术公司uniQure。该药用于治疗一种极其罕见的遗传性疾病——脂蛋白脂肪酶缺乏症(LPLD)。脂蛋白脂酶缺乏病症十分罕见,每百万人中约有一到两例患者。患有脂蛋白脂酶缺乏症之后,患者体内的血液无法承受任何脂肪颗粒,而且这类患者在饮食方面禁食正常餐饮,因为患者容易出现各种急性胰腺癌病症。
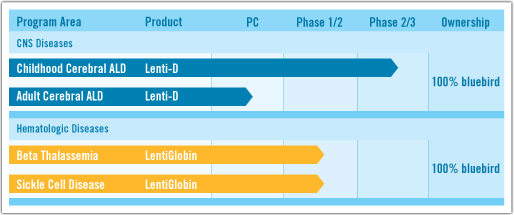
在2012年7月,bluebird bio公司在D轮融资中获得了6000万美元投资,用于推进儿童脑型肾上腺脑白质营养不良(CCALD ,childhood cerebral adrenoleukodystrophy)、β-地中海贫血症以及镰刀细胞病等疾病疗法的临床项目。今年,bluebird bio公司计划在欧洲和美国启动CCALD的II期和III期临床研究,并在美国启动β-地中海贫血症的I期和II期研究。
2012年2月,Celladon公司完成了4300万美元的股权融资,用于推荐该公司用于治疗心衰的主要候选药物MYDICAR的临床开发。
Celladon公司的基因治疗的理念是把心衰当做一种酶缺乏症进行治疗。在所有的心脏衰竭疾病中,均是由于一种叫做SERCA2a的ATP酶的急剧下降。Celladon的药物MYDICAR针对SERCA2a,能够减少心脏收缩时的耗氧量。在临床试验中,MYDICAR在心脏功能参数以及生活质量方面均能够为患者提供持续(一年)的改善效果。此外,Celladon还研发SERCA2a的小分子活化剂用于救治急性心衰。
药企对基因治疗态度暧昧
所有的这些事件意味着什么呢?首先,这说明已有足够的临床数据支持基因治疗的概念。很多的风险投资基金(而非医药行业)正在意识到基因治疗的潜力并参与到这个领域中来。
事实上,目前很少有医药行业的巨头在进行基因治疗的研发。赛诺菲的子公司Genzyme在此类项目中的管线包括处于II期的帕金森症疗法AAV-hAADC,处于I期的年龄相关黄斑变性疗法AAV-sFLT以及其他的产品管线。在赛诺菲收购Genzyme一年多后,其基因治疗项目的未来仍不清晰,不过赛诺菲也没表示要放弃这一块。
那些唾手可得的成果——比如那些在基因治疗领域中与大多数早期症状有关的罕见病——对药企很有吸引力,当某个候选产品具有引人注目的临床数据时,药企也愿意开展研发行动。不过药企比生物技术公司或者风投更具有市场敏感性,风投更多地基于积极的临床数据、平台验证概念的更广泛影响进行投资。
与药企不同,风险投资与生物技术投资者的投资行为更多的是由那些尚未满足的患者需求来驱动的。未满足的需求转变为投资的监管批准过程更为简单,在价格方面也更具有弹性。在这种条件下就很容易开发出一种药物。
由于药企选择某种疾病进行投资的标准要比风投和生物技术投资者严格的多,如果在针对某种疾病疗法进行投资时采用非常严格、全面的标准,那么基因治疗就存在一些问题,最主要的就是商业模式以及对于技术风险的担忧。
基因治疗的投资策略
如何选择某项基因治疗产品进行投资?下面是非常结构化的选择标准:
● 技术风险:是否有足够的临床前和临床数据表明这一产品会有功效?是否已经知道应该用什么基因?对于隐形遗传疾病,那是很清楚了。如果是后天的疾病,可能就无法知道在哪里对组织进行改造。
● 需求:对于基因治疗来说,由于目前大多仍然是未经测试的,因此从风险—效益角度来看,其需求必须非常的高。
● 市场规模:市场规模是选择基因治疗进行投资的第三条标准。
● 临床评估:这是在进行基因治疗投资决策时最重要的一条标准。
临床评估应该进一步分为两个方面。首先,是否有生物标记物可以在I期或II期中回答以下问题:基因成功整入载体了吗?载体是否递送了这个基因?基因是否表达了?是否发挥了应有功能?
第二,临床试验结果应该怎么样?何时进行注册?因为在基因治疗中,很难开展安慰剂对照双盲研究。