
缺铁是为人们所熟知的认知、语言和动力发育受损的原因,然而最新一项报告发现,即使是看起来比较健康的年轻成年人,铁离子水平的变化也与大脑结构完整性有关。这项研究发表在1月9日发表的《美国国家科学院院刊》杂志上。
加利福尼亚大学的George Bartzokis 表示,“研究人员对铁代谢和白质(更具体的说是髓鞘质)做了非常有趣的联系。”他本人并未参加这项研究。“所了解的髓鞘质或可以有所启发,因为它事实上含有大量的铁,所以用图像在人类身上直接阐述很有意义。
缺铁的儿童——通常是饮食不好的结果——在数学和语言测试中得分很低。考虑到这些因素,UCLA的 Paul Thompson以及他的同事决定调查正常的儿童,结果发现铁离子水平变化时,测试结果也有变化,而且让人惊讶的是,影响还很大。
研究团队测量了青少年血清中的转铁蛋白水平——一种相反但却更可靠的测量铁含量的方法,然后这些青少年20岁时对其进行脑部扫描。研究小组还通过弥散张量成像技术(DTI)观察了髓鞘质的功能,并且发现青少年的铁水平和髓鞘质的完整性呈较强的正相关。
Thompson说,“我们非常惊讶当发育的时候在饮食中摄入适量的铁会对大脑有怎样的影响。”最简单的启示是,在发育的时候,青少年饮食中摄入铁和大脑更好的完整性有关。
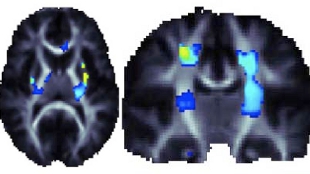
脑部扫描发现基因变体改善了大脑的完整性(图中黄蓝区域)
Thompson和他同事同时调查了是否有基因与铁的利用率和大脑的结构有关。研究项目纳入了同卵双生和异卵双生的双胞胎,结果发现同卵双生的铁水平和髓鞘质联系更紧密。也就是说,一双胞胎铁水平较高更好的预测另一个双胞胎髓鞘质的完整性。
研究人员更进一步研究了两个铁代谢基因,发现其中一个基因HFE的多态性——HFE调控细胞吸收携带铁的转铁蛋白——与高铁水平和白质完整性改善有关。
宾州州立大学的James Connor说,“当然这种多态性并不意味着更好的大脑功能。而当前的研究并没有对与多态性,或实质上与血清转铁蛋白或白质完整性间的此种关联进行调查,而这些都是很重要的。这种联系与多形态,血清转铁蛋白或白质完整性——”人们会想知道这些差别是否与认知技能有关。
即使HFE变体不改善大脑功能,还是存在风险,同样的变体有可能对老年人产生危害。研究已经证明大脑中铁的堆积会诱发多种神经退化性疾病。Thompson说, “所以这是把双刃剑”。
Connor说,还有一件事是确定的:这种多态性是普遍存在——12-15%白种人携带这种变体——不管结果出来怎样,“这些数据将和很大比例的人口有关。”

Brain structure in healthy adults is related to serum transferrin and the H63D polymorphism in the HFE gene
Neda Jahanshada,b, Omid Kohannima, Derrek P. Hibara, Jason L. Steina, Katie L. McMahonc, Greig I. de Zubicarayd and Paul M. Thompsona,
Control of iron homeostasis is essential for healthy central nervous system function: iron deficiency is associated with cognitive impairment, yet iron overload is thought to promote neurodegenerative diseases. Specific genetic markers have been previously identified that influence levels of transferrin, the protein that transports iron throughout the body, in the blood and brain. Here, we discovered that transferrin levels are related to detectable differences in the macro- and microstructure of the living brain. We collected brain MRI scans from 615 healthy young adult twins and siblings, of whom 574 were also scanned with diffusion tensor imaging at 4 Tesla. Fiber integrity was assessed by using the diffusion tensor imaging-based measure of fractional anisotropy. In bivariate genetic models based on monozygotic and dizygotic twins, we discovered that partially overlapping additive genetic factors influenced transferrin levels and brain microstructure. We also examined common variants in genes associated with transferrin levels, TF and HFE, and found that a commonly carried polymorphism (H63D at rs1799945) in the hemochromatotic HFE gene was associated with white matter fiber integrity. This gene has a well documented association with iron overload. Our statistical maps reveal previously unknown influences of the same gene on brain microstructure and transferrin levels. This discovery may shed light on the neural mechanisms by which iron affects cognition, neurodevelopment, and neurodegeneration.
文献链接:https://www.pnas.org/content/early/2012/01/04/1105543109








