Scripps研究所的科学家开发了一种特殊的分子开关,该开关可以嵌入基因疗法中,使医生能够控制剂量。

免疫学教授Michael Farzan博士与团队。图片来源:Scripps研究所
《Nature Biotechnology》报道了这一壮举,它为基因疗法设计人员提供了可能是第一种调整其治疗基因活性水平的可行技术。基因疗法通过将治疗性基因的拷贝插入患者的细胞来发挥作用,但是一旦将基因拷贝传递到患者的细胞中,就无法将其关闭或调节,因此迄今为止只有少数几种基因疗法被FDA批准。正是缺乏这样一种基本的安全特性限制了基因疗法的发展,这项技术解决了一个主要的安全问题,扩大了其使用范围。

https://doi.org/10.1038/s41587-019-0357-y
由首席研究员Michael Farzan博士领导的Scripps研究小组通过将其纳入一种治疗贫血的产生促红细胞生成素(EPO)的基因疗法中,证明了这一技术的力量。他们可以使用一种特殊的嵌入分子将其基因表达抑制到非常低的水平,也可以使用注射的称为吗啉代(morpholinos)的控制分子在很宽的动态范围内提高该基因的表达,FDA已发现这种控制分子对其他应用是安全的。
研究人员从一个锤头状核酶的RNA分子家族中制备了转基因开关,这些核酶具有非凡的特性,一旦将其从编码的DNA转录到RNA中,便被切成两半。因此含有这种核酶的DNA的治疗性转基因的转录本往往是分成两部分的,然而,核酶的这种自我切割作用可以被锁在核酶活性位点上的RNA样吗啉代阻断,这时转基因转录本将保持完整并被翻译成治疗性蛋白质。核酶有效地充当了转基因的“关闭开关”,而注射到转基因所在组织中相匹配的吗啉代能有效地使转基因重新“打开”,其程度取决于吗啉代的剂量。科学家们从一种称为N107的锤头状核酶开始,经过几个月的实验修饰核酶,直到其动态范围扩大数十倍。
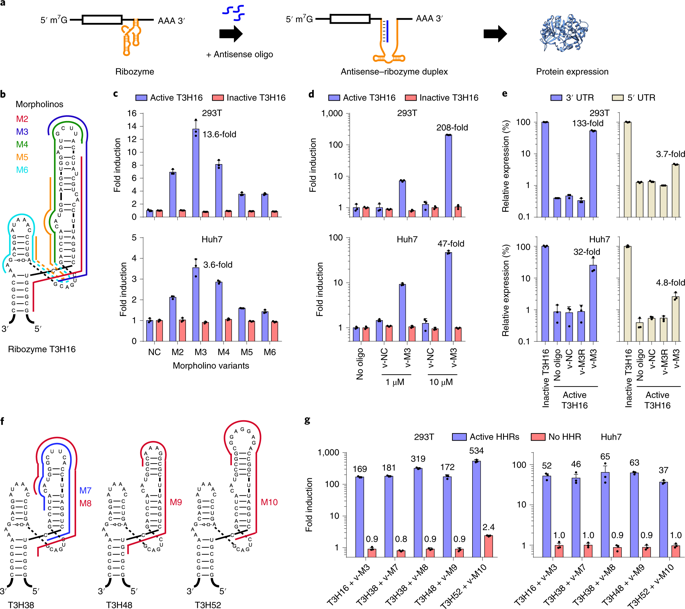
使用优化的III型核酶可有效调节基因表达
研究小组随后在EPO基因疗法的小鼠模型中展示了基于核酶的开关,该模型虽然尚未获得FDA批准,但被认为比目前用于治疗与严重肾脏疾病相关的贫血的方法更好。他们向小鼠的肌肉组织中注射了EPO转基因,结果表明嵌入的核酶将EPO的产生抑制到非常低的水平,然后将少量的吗啉代分子注射到受影响的组织中,极大地逆转了这种抑制作用,EPO的产量增加200倍以上并且持续了一周以上,而标准注射的EPO半衰期只有几个小时。这些特性使基于核酶的开关具有实际的临床应用潜能。

EPO转基因的体内调节
Farzan认为这种方法“是目前调节动物或人类基因疗法剂量的唯一实用方法”,该技术的简单性以及吗啉代已获得FDA批准的事实,可以使新的转基因开关系统用于各种设想的基因疗法中。在未来的研究中,Farzan和他的同事们将努力适应他们的核酶开关技术,以便将其用作基因疗法的故障保护机制,从而使错误的转基因永久性地失活。