中国科学院高福院士在自然出版社与川大华西医院生物治疗国家重点实验室联合主办的 《Signal Transduction and Targeted Therapy》(STTT)上发表了发表PD-1/PD-L1抗体展望,高福院士为该文的通讯作者,谭曙光助理研究员为第一作者。
免疫治疗是目前肿瘤药物研究的热点,是目前多个制药企业的研发重点项目。特别是,目前PD-1抗体和PD-L1抗体的临床治疗已经取得了巨大的进展,默沙东制药的PD-1抗体Keytruda(pembrolizumab,MK-3475)和百时美的PD-1抑制剂Opdivo(Nivolumab, BMS-936559)都已经获得FDA批准上市,这两个药物目前在进行多个临床试验,希望扩大适应症。同时值得关注的在研有罗氏的PD-L1抗体药物MPDL3280A,阿斯利康的PD-L1抗体药物MEDI4736,默克与辉瑞合作开发的PD-L1抗体avelumab等,这些药物目前均在进行临床实验。然而遗憾的是,这些抗体药物的作用分子机制目前尚不完全清楚。
而细胞程序化死亡受体-1(PD-1,programmed death 1)与细胞程式死亡-配体1(PD-L1,programmedcell death-Ligand 1)结合,可以传导免疫抑制信号,降低T细胞的增生,从而起到免疫抑制作用。PD-1是CD28超家族中的一员,作为一种重要的免疫抑制分子,在肿瘤微环境中大量表达,但肿瘤细胞可以在自身表面产生PD-L1,当T细胞表面的PD-1识别PD-L1后,能抑制T细胞的活化或诱导T细胞凋亡,抑制免疫反应的发生,从而使肿瘤逃避免疫系统的攻击。阻止PD-1和PD-L1相互识别过程,可以解除肿瘤细胞对免疫系统的“隐身”效果,从而实现对肿瘤的免疫治疗。PD-1和PD-L1均可作为治疗的靶点,PD-1抗体与PD-L1抗体均可阻止二者的相互识别,增强T细胞免疫应答,从而使T细胞能够识别并杀死肿瘤细胞。
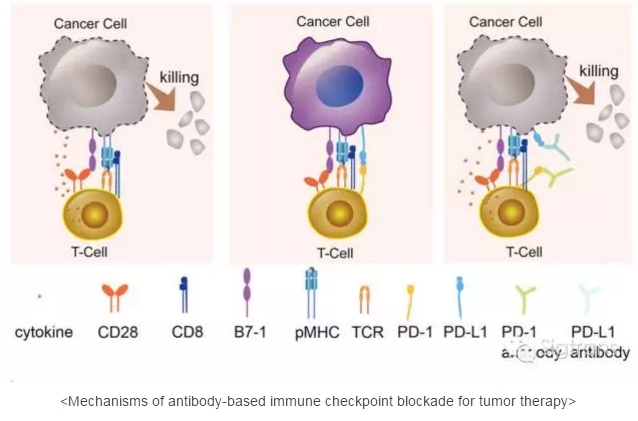
2016年,高福院士团队通过结构免疫学平台,成功解析了avelumab抗体与人PD-L1分子的复合物结构,同年,宋海卫教授团队也成功解析了pembrolizumab和PD-1作用的复合物结构。在这篇展望中,高福院士总结了这两项研究的成果,指出了目前研究尚未解决的问题,并展望了未来如何开发更有效的PD-1抗体和PD-L1抗体、小分子药物以及其它蛋白和非蛋白抑制剂
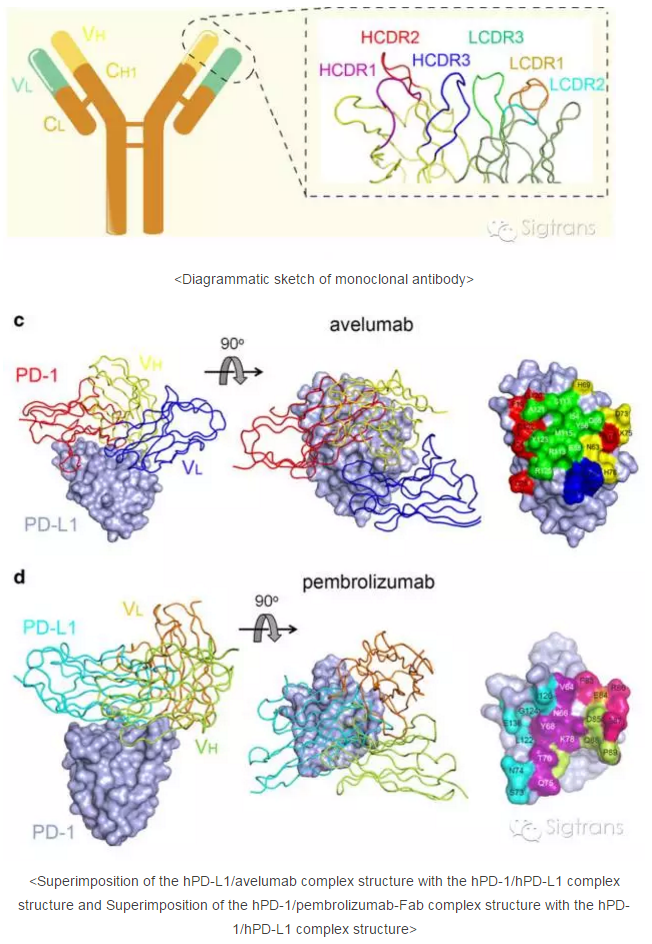
从这两项研究发现的复合物结构中可以看出,单克隆抗体主要通过其重链和的轻链的CDR loop与PD-1/PD-L1进行结合,而免疫启动离不开fragment crystallizable(Fc)区域。Avelumab抗体主要通过其重链的三个CDR loop与PD-L1相互作用,而轻链的CDR1和CDR3 loop则贡献了部分相互作用。PD-L1主要通过其C,C’,F和G折叠片及CC’ loop与avelumab相互作用,其中CC’ loop同时与avelumab的轻链CDR3和重链CDR3相互作用并有多个氢键参与。通过对avelumab抗体与PD-1竞争结合PD-L1机制的分析,发现avelumab主要通过其重链的CDR2与PD-L1的F和G折叠片结合来竞争PD-1与PD-L1的相互作用,其在PD-L1上的结合区域与PD-1与PD-L1相互作用区域部分重叠。研究还表明,avelumab与PD-L1的亲和力(Kd)为47.2 pM,远高于PD-1与PD-L1相互作用亲和力(0.77-8.2 μM)。因此,高亲和力的avelumab通过其重链CDR2结合PD-L1的F和G折叠片后能够阻止PD-1结合PD-L1,进而阻断PD-1/PD-L1的相互作用。
此外,高福院士也指出,尽管PD-1和PD-L1的单克隆抗体取得了成功,但尽管小分子抑制剂或低分子量蛋白药物或许可能具有更好的治疗效果。首先,单克隆抗体与PD-1/PD-L1的结合需要两者相互靠近,但单克隆抗体分子量太大,很难在肿瘤微环境中达到所需要的浓度;其次,保留了Fc片段和单克隆抗体会引起免疫毒性反应。而目前对于结构的解析,为小分子抑制剂及低分子量蛋白的设计提供了依据。
Signal Transduction and Targeted Therapy简介
《Signal Transduction and Targeted Therapy》(STTT)是自然出版集团和四川大学华西医院生物治疗国家重点实验室合作出版的全英文生物医学专业期刊(网站:https://www.nature.com/sigtrans,点击本网站最下方"阅读原文”)。主编由美国俄亥俄州立大学Carlo M. Croce教授(美国三院院士,Cancer Research前主编),UCSD的张康教授、川大华西医院魏于全教授担任。有来自全球等多个国家及地区的多位相关领域的近百位著名学者组成编委会。







