
中国科学院上海生命科学研究院生物化学与细胞生物学研究所分子生物学国家重点实验室/国家蛋白质科学中心•上海许琛琦研究员是这篇题为“Regulation of T cell signalling by membrane lipids”的综述的通讯作者。
一篇提出新型免疫疗法的Nature

小编初识这位“大神”要从今年3月发表在Nature上的一项成果说起。在题为“Potentiating the antitumour response of CD8+ T cells by modulating cholesterol metabolism”的这一研究中,许琛琦研究组和分子生物学国家重点实验室李伯良研究组发现,“代谢检查点”可以调控T细胞的抗肿瘤活性,并鉴定出了肿瘤免疫治疗的新靶点——胆固醇酯化酶ACAT1以及相应的小分子药物前体。研究证明了细胞代谢对肿瘤免疫应答起到了关键作用,开辟了肿瘤免疫治疗研究的一个全新领域。
尽管基于T细胞的肿瘤免疫治疗(如PD-1/PD-L1抗体等)已经取得巨大的成功,但是现有的治疗方法只对部分病人有效。除了想方设法改善现有疗法,一些科学家也在寻找新的突破口。许琛琦与李伯良研究组证实,通过调控T细胞的“代谢检查点”可改变其代谢状态,使其获得更强的抗肿瘤效应功能。

抑制ACAT1增强CD8+ T细胞的肿瘤杀伤功能
胆固醇酯化酶ACAT1可以将细胞内的游离胆固醇转化为胆固醇酯。抑制CD8+ T细胞的ACAT1活性可以使细胞质膜的游离胆固醇水平上升,从而使得TCR信号增强并让杀伤性免疫突触更成熟。T细胞肿瘤抗原免疫应答由此变得更加高效。
具体来说,研究小组发现T细胞代谢通路中的胆固醇酯化酶ACAT1是一个很好的调控靶点,抑制ACAT1的活性可以大大提高杀伤性T细胞的抗肿瘤功能。因为ACAT1被抑制后,杀伤性T细胞膜上的游离胆固醇水平提高,从而让T细胞肿瘤抗原免疫应答变得更加高效。同时,科研人员还利用ACAT1的小分子抑制剂avasimibe在小鼠模型中治疗肿瘤,发现该抑制剂具有很好的抗肿瘤效应;并且avasimibe与现有的肿瘤免疫治疗临床药物anti-PD-1联用后效果更佳。

最新综述:全面聚焦调节膜脂质免疫疗法
胆固醇是细胞膜脂质的重要组成成分,也是T细胞能够迅速增殖的物质基础之一。这篇最新的综述强调,基于脂质的免疫疗法有望成为一种新的临床策略。
引言
过去的几十年来,科学家们对T细胞信号进行了广泛的研究。这些努力为开发癌症和自身免疫疾病的新疗法铺平了道路。其中,免疫检查点抑制剂疗法取得了巨大的成功。过去关于T细胞信号的研究主要集中在蛋白质、DNA或RNA上。调查脂质作用的研究非常有限。然而,一些新兴的数据表明,膜脂质在T细胞信号中有着非常复杂的作用;此外,在临床前模型中,调节T细胞中的膜脂质能够治疗多种疾病。这一综述中,作者们讨论了质膜(plasma membrane)脂质在T细胞信号中的功能,以及基于脂质的免疫疗法。
模块一:膜脂质动力学
脂质分子是细胞的关键组成模块,且极其多样。理论上说,共有约180,000种不同的脂质存在,分别属于八个不同的类别:glycerophospholipids, sterol lipids, sphingolipids, fatty acyls, glycerolipids, prenol lipids, saccharolipids和polyketides 。哺乳动物含有的主要脂质类别是glycerophospholipids, sphingolipids 和 sterol lipids(图1a)。不同的脂质在细胞中表现出了共调节(co-regulation)作用,且在相似代谢途径和细胞位置发现的脂质这种作用更强。(图1b)。
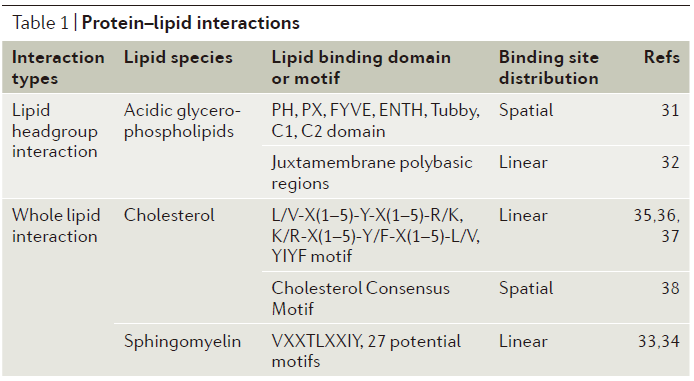
这一模块主要介绍了脂质的分布(图1c)、扩散、组成动力学以及脂质-蛋白交互作用(表1)等内容。
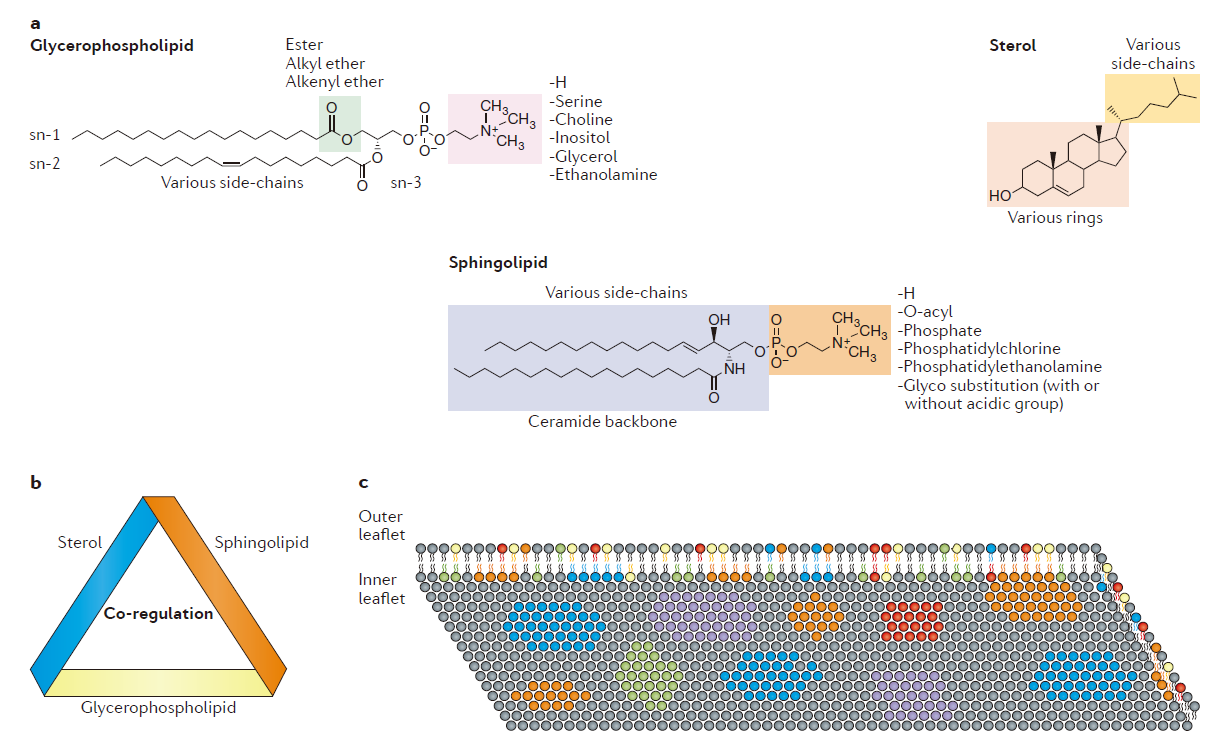
Figure 1 | The nature of plasma membrane lipids.
图片来源:Nature Reviews Immunology
模块二:膜脂质介导的T细胞信号调控
膜脂质环境的复杂性参与了T细胞信号复杂的时刻调控。在这一部分内容中,作者们总结了T细胞中不同脂质类型的几个关键调控模式。很明显的一点是,一种脂质类型对调控T细胞信号具有多重效应。该板块包括了免疫突触的形成、脂质与免疫受体的安全调控、脂质调节膜蛋白构象(图2)、分区和流动性等6部分内容。
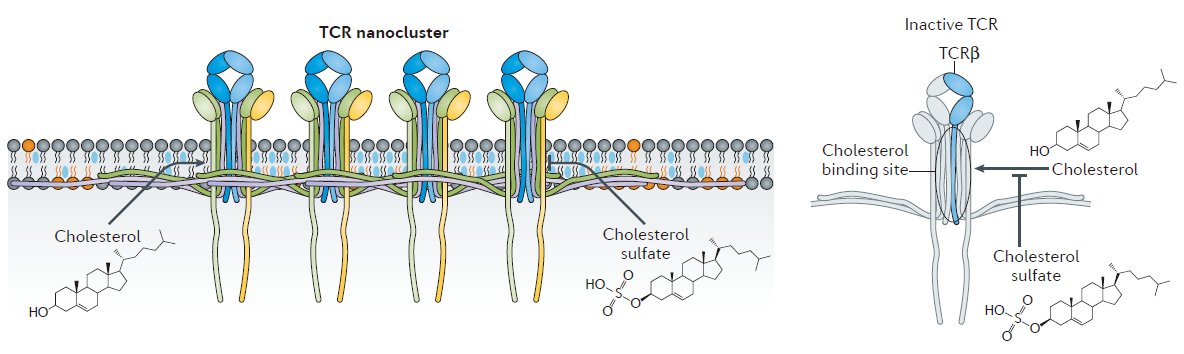
Figure 2 | Regulation of membrane protein clustering and conformation by cholesterol.
图片来源:Nature Reviews Immunology
模块三:调节T细胞膜脂质治疗疾病
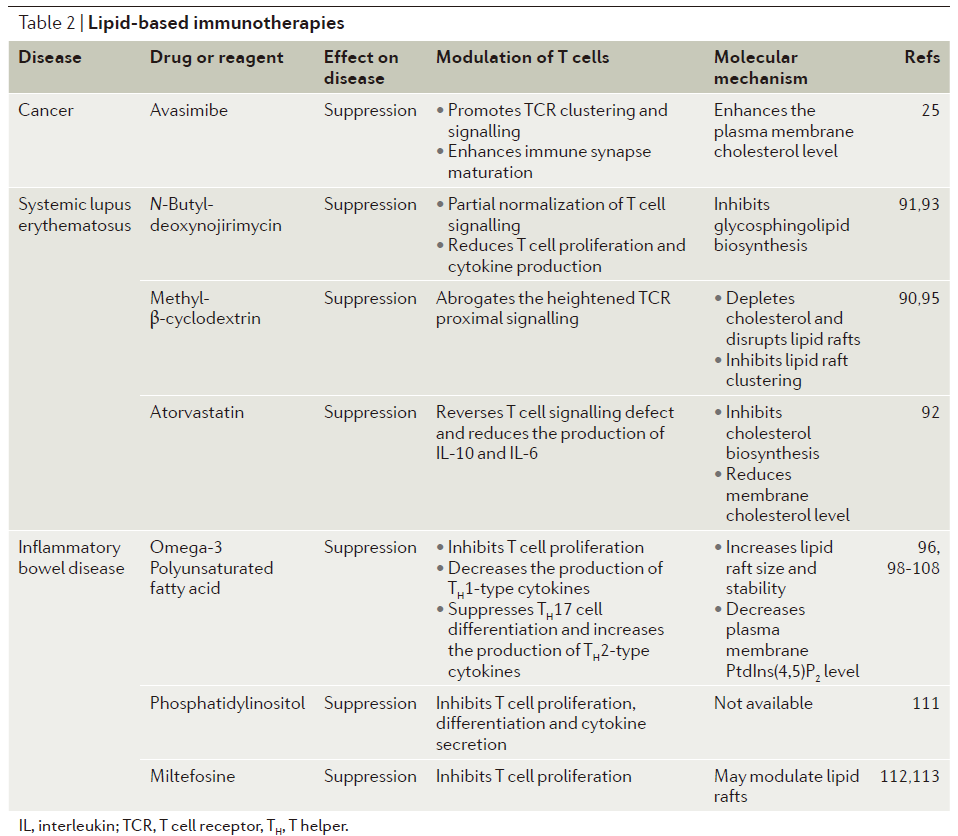
调节T细胞信号治疗人类疾病的概念在临床上得到了很好的验证。免疫检查点疗法取得了前所未有的成功,也触发了T细胞信号研究的新热潮。在这一部分内容中,作者们强调,调节T细胞膜脂质这一新兴理念也能够被用于治疗人类疾病,如癌症和自身免疫疾病(表2)。这些进展可能会推动新一代免疫疗法的发展。
总结与展望:3个关键问题需要进一步解决
过去几年的研究揭示出了膜脂质在T细胞信号中的显著作用。癌症和自身免疫疾病临床前模型研究也证明了调节T细胞膜脂质能够带来令人鼓舞的效果。然而,我们依然处在完全理解膜脂质生理和病理功能的早期阶段。这显著影响了新一代药物的开发。作者们指出,未来有3个关键问题需要进一步解决:
1)活T细胞中膜脂质动力学:相比已经达到单细胞水平的基因组学和蛋白质组学技术,脂质组学技术仍在发展中,且仅有有限数量的中心和公司提供这类服务。T细胞脂质组学的研究更为罕见。研究者们急需新的脂质组学技术来研究活体T细胞中的脂质组成动力学。结合脂质组学和功能分析揭示了各种脂质在先天免疫反应中的不同作用。此外,研究T细胞中的脂质分布动力学还需要高速超分辨率成像技术。
2)T细胞亚群中的不同膜脂质环境:很明显,不同的T细胞亚群有着不同的膜脂质环境。未来的研究需要聚焦这些亚群(如CD8+ T细胞、CD4+ T细胞、调节性T细胞)之间的区别。更重要的是,研究者们需要研究不同的膜脂质环境如何调控T细胞信号,从而决定这些T细胞亚群特定的功能。
3)开发新型膜调节药物:过去的临床前模型研究已经证明了膜调节药物在调节T细胞功能方面的应用前景。未来需要更多基于人类T细胞的研究。脂质代谢途径中的蛋白质已经成为了科学家们积极研究的对象,用作代谢疾病的药物靶点。许多药物已经在临床上进行测试。未来,研究者们还可以探索它们的新应用——在癌症、自身免疫疾病以及感染性疾病中调节T细胞的功能。

关于许琛琦研究员(资料参考自上海生命科学研究院官网)
研究员,研究组长,博士生导师,所长助理
个人简介:1998年,华东师范大学生物化学专业,理学学士;1998-2001,华东师范大学与中科院生化所联合培养理学硕士;2001-2004年,中科院生物化学与细胞生物学研究所,理学博士。2004年赴美国哈佛大学医学院Dana-Farber肿瘤研究所从事免疫学研究,先后为博士后,instructor。2009年11月回生化与细胞所工作,担任研究员,研究组长,现任所长助理。2005年获上海市科技进步一等奖,2010年入选中科院“百人计划”,2014年获得国家杰出青年基金资助,2015年入国家“万人计划”青年拔尖人才及上海市科委优秀学术带头人计划。
研究方向:淋巴细胞与疾病(1. T淋巴细胞活化机制;2. T淋巴细胞在疾病中的作用)
代表性论文:据官网介绍,许琛琦研究员已累计在Nature、Cell、 Nature Communications、 Cell Research等杂志上发表论文近30篇。
参考资料
上海生命科学研究院:上海生科院发现提高T细胞抗肿瘤免疫功能的新方法
相关文献:
Nature:Potentiating the antitumour response of CD8+ T cells by modulating cholesterol metabolism







