
乔治·丘奇(George Church)
最近,《纽约时报》的一则消息披露,5月10日,由大约150名科学家、律师以及企业家参与的一场秘密会议,探讨了人工合成人类基因组的可能性。该会议由哈佛医学院教授乔治·丘奇(George Church)等人牵头,项目名称为:人类基因组计划之细胞内大型人造基因组测试(HGP-Write: Testing Large Synthetic Genomes in Cells)。原本这项会议不会在媒体、社交网站上公开,但会议内容被几名受邀的科学家告密,于是引起公众的强烈不满,并对该项目的道德伦理问题表示担忧。事实上,这次秘密会议也吸引了顶级杂志Science以及Nature的关注。
事实上,生物狂人克雷格·文特尔(Craig Venter)3月就向伦理学家们投下了一枚重磅炸弹。3月下旬,他以及他的研究团队在《科学》(Science)杂志发表一项重要研究:历经15年时间,他们人工合成了迄今为止最小基因组的生命体。余音未落,另一名如同文特尔一样疯狂的天才科学家丘奇,则直指人类细胞基因组。从最小的生命到人类本身,人类正在扮演造物主,设计和制造生命,合成生物学也逐渐步入公众的视野。

克雷格·文特尔(Craig Venter)
合成生物学最早出现于1910年。但直到1974年,波兰遗传学家Waclaw Szybalski给予其较为明确的定义:将设计新的控制(基因)元件、模块并加入到已有的基因组或者从头创建新的基因组。
现代合成生物学作为一门新兴的学科,只有十几年的历史。2000年,美国波士顿大学James Collins设计的“双稳态开关”以及加州理工学院Michael Elowitz设计的“自激振荡环”并称为合成生物学的发端之作,证明搭建人工基因线路并在生物体内实现其逻辑功能的可行性,它们奠定了合成生物学理论的基础。至今其概念理论已经扩展到细胞内信号通路的重连接、胞内的RNA逻辑线路、细胞间通信的多细胞体系的人工设计等。
简单来讲,合成生物学是人工合成自然生命不具有的某些复杂功能,或者人工设计生命。这一突破性进展的意义不言而喻,这显示人工合成生命体帮助人类完成一些原本看似不可能的任务,已经并非天方夜谭。

生命体系的不同基本单元
从生物合成到人工合成生命
传统意义上的合成生物学已经有很多应用的经典案例,如:青蒿素、紫杉醇、阿片类药物这些原本需要在植物中提取的化合物的人工合成,都实现了人工将复杂的基因线路导入到发酵工程细菌中的目标。人工合成青蒿素主要是由来自美国劳伦斯伯克力国家实验室的Jay Keasling团队完成,首先实现了将10个酶的合成通路在大肠杆菌体系中载入,从而实现了青蒿酸的合成,随后将这个合成途径转移到发酵效率更高更成熟的酵母发酵体系中。另一个成功的案例是阿片类止痛药的生物合成,阿片类药物主要从罂粟中提取,斯坦福大学的Christina Smolke带领的团队花费了十年的时间,将阿片类合成的5个基因导入酵母基因组,实现了在发酵过程中生产阿片类药物。
严格意义上来讲,人工合成生命要合成完整的细胞结构并使其传代,所有的细胞器和细胞内结构、物质全部由人工合成。许多科学家在为合成细胞器而努力,比如:线粒体、叶绿体、细胞核等的人工合成,试图通过单个细胞器合成之后进行组合,人工组建完整的细胞。另外一些科学家则认为,虽然是利用天然的细胞作为起始,但是植入了人工合成的基因组,经过稳定的传代,那么天然的成份会被替代,从而得到稳定的由人工合成的基因组编码的生命体,从遗传意义上来讲,这也是人工合成的生命体。
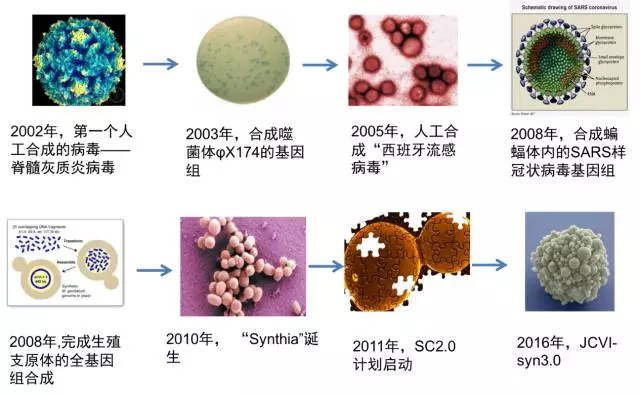
人工合成基因组的历史
人工合成基因组的历史其实并不算悠久,第一个人工合成的基因组是2002年的人工合成脊髓灰质炎病毒,这是一个7500个碱基的RNA基因组。但是病毒并没有真正意义上的细胞结构,无法在离开宿主的细胞结构后完成复制,我们还不能称之为真正意义上的生命,但是为人工合成基因组奠定了理论和方法学基础。随后科学家们合成了噬菌体和病毒、支原体的基因组。真正意义上里程碑式的事件发生在2010年,文特尔发布了第一个人造细胞结构生命体基因组辛亚娅(Synthia)的出现。
辛亚娅的基因组总共约1.08 兆碱基对(Mbp),完全通过人工用化学合成的方式合成,将其移植进一个山羊支原体受体细胞,从而创造了一个仅由合成染色体控制的新的蕈状支原体细胞。为了合成辛亚娅,文特尔团队用了15年,花费了4000万美元。
JCVI-syn3.0是在辛亚娅工作的基础上,做了基因组的“精简”,将基因组精简为0. 531兆碱基对,几乎为原来的一半,而基因数也从850个精简到473个,虽然还包含149个未知功能的基因。这是人类已知最精简的基因组。
2011年启动的SC2.0项目是人工合成真核生物“酵母”的基因组的研究项目。该项目由美国纽约大学Jef Boeke教授发起,涉及中英美法澳新六个国家,十个研究团队;国内深圳华大基因研究院(3条)、天津大学(2条)、清华大学(1条)参与了16条染色体中6条染色体的合成工作。3号染色体的全合成工作于2014年完成,发布于《Science》杂志,由Jef Boeke教授牵头完成,堪称合成基因组史上里程碑式的结果。而国内团队完成的工作,也将很快发表。
合成人类基因组,“上帝”的工作
如果说人类合成“简单生命”的过程只是证明了人工合成基因组本身理论可行,那么这次丘奇教授则是跳过了“从简入难”的过程,直接挑战极限。
前文提到的人类迄今为止合成的最复杂的基因组是酵母的基因组,酵母基因组有16条染色体1200万个碱基对,跟人类基因组的30亿个碱基对相差百倍,而酵母基因组的合成,已经用去了科学家们超过5年的时间。在上游DNA合成和组装技术没有“跨越式”发展的大背景下,合成人类基因组的工作量和成本,将是合成酵母基因组的数百倍。并且微生物的实验操作相对简单,而人的基因组复杂度要高很多倍。
理想的人工合成基因组,需要面临几个挑战:
用化学合成方法合成正确的基因组。化学合成DNA的正确率为99%~99.99%,按照这个错误率合成100个碱基,那就是99%100≈36.6%,如果是百万碱基的基因组,那么直接人工合成将不可能。科学家们首先要发展精确合成DNA的技术,合成错误纠正的技术、片段组装技术、核酸修饰技术等等。
化学合成的基因组是否能像生命体自身合成的那样工作。虽然看起来成分一样,但是人工合成的基因组是否能像“天然的”那样工作,确实需要验证。这就是辛亚娅的价值。证明人工合成的基因组植入到自然细胞之后,依然能稳定的工作。辛亚娅也经历了忽略DNA修饰而无法工作的问题。这些问题和教训的积累为后期的工作提供的很好的经验。
哪些基因是维持生命必须的。基因组的表现语言相关的研究已经很多,但是基因组的设计语言,人类了解的还很少。我们知道基因组的大小和功能基因的数量并不是一直处于线性关系,这叫C值悖论。越是“高等生物”的基因组,冗余的非功能基因越多。那么对于每一个生命体,是否存在“效率”最高的状态。科学家把维持生命最基本的基因称为必须基因(Essential gene),包括几大类:维持生命相关的基因、自我复制相关的基因等。这就是JCVI-syn3.0的价值。
了解基因组的工作方式,人造生命的鲁棒性。鲁棒性(robustness)就是系统的健壮性。虽然人工能够完成基因组的合成,但是人工合成的基因组是不是足够强壮,是不是能够抵御“恶劣”的生存环境却是一个需要面对的问题。
多细胞生命体人工合成。从人工合成生命的发展历史来看,从病毒到细菌,从原核到真核,这是人造生命的既定发展之路。而高等的生命体,基因组的修饰和包装方式更加复杂,并且有多细胞发育的问题,人类面临的挑战将更大,这样的系统是不是能被人类操控依然是个未知数。







