小分子抑制剂的发现需要再蛋白质表面有合适的结合袋,缺乏这一特征的蛋白质被认为是不可药用的,这就需要创新性的治疗性策略;KRAS是癌症中最为频繁的被激活的癌基因,而KRAS突变体的激活状态则是一个令人难以捉摸的靶标。
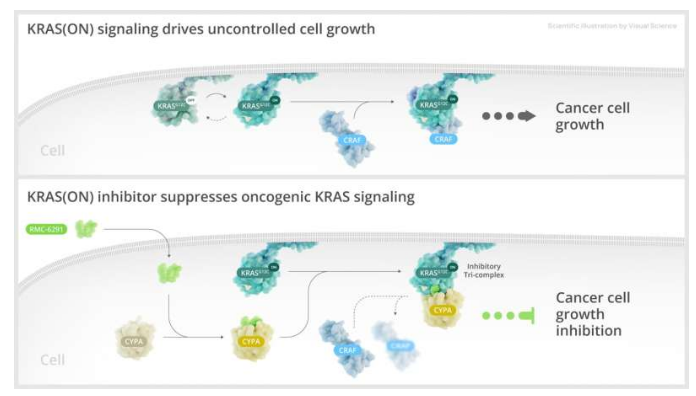
近日,一篇发表在国际杂志Science上题为“Chemical remodeling of a cellular chaperone to target the active state of mutant KRAS”的研究报告中,来自纽约纪念斯隆凯特琳癌症研究中心等机构的科学家们通过研究开发了一种新方法,其或能绕过一种常见的致癌突变不可药用特质,这种致癌突变会驱动癌症发生以及对当前疗法的耐受性。在这篇文章中,研究人员引入了一种能靶向作用活性突变KRAS的新方法,从而有望解决“不可药用”的挑战(undruggable challenge);KRAS是一种臭名昭著的经常与多种癌症发生相关的细胞信号基因,其在驱动失控的细胞生长和增殖方面扮演着重要角色,KRAS突变存在于大约25%的肿瘤中,且是32%的肺癌、40%的结直肠癌和85%的胰腺癌病例背后的驱动突变,KRAS突变是人类机体中最常发生的致癌突变。科学家开发出了一种新型的KRAS解决策略 或有望克服“不可药用”的障碍。图片来源:Science (2023). DOI:10.1126/science.adg9652由于KRAS在多种人类癌症中扮演着重要角色,因此其也成为了治疗干预的主要目标,KRAS蛋白上缺乏合适的药物结合位点会成为开发有效药物疗法的重大障碍,从而就导致其被贴上了“不可药用”的标签,在现代科学中,诸如“不可药用”、“无法治疗”和“原因不明”等标签的保质期越来越短。这项研究中,研究人员制造出了一种名为RMC-6291的小分子,其具有精确靶向的新形态结合界面,研究人员战略性地改造了RMC-6291分子使其能与天然细胞伴侣CYPA和KRAS蛋白上的点突变形成三重复合体,当RMC-6291处于交叉位置时,这种相互作用就会被干扰,从而关闭由KRAS所驱动的型号通路。除了适用于KRAS的单点突变外,该研究还强调了这种方法策略必须扩展到其他具有挑战性的目标的潜力,这或许就为解决此前被认为超出药物开发范围的更广泛的致癌基因提供了一定的可能性。最后研究者表示,与任何新发现或创新性的方法一样,后期研究人员还需要进一步研究,目前他们正在进行关于RMC-6291 (NCT05462717)的1/1B期临床试验。