G蛋白偶联受体(G Protein-Coupled Receptors, GPCRs)是一类广泛存在于人体细胞膜上的膜受体,是细胞信号转导的重要调节分子。GPCRs参与调控人体几乎所有的生命活动过程,从化学感知,包括视觉、嗅觉、味觉,到内分泌分子相关的调节,包括神经传递、免疫调节、代谢调节等。人体基因组能编码超过800个GPCRs。目前,FDA批准上市的临床药物中,约三分之一的药物作用于GPCRs发挥治疗作用,GPCRs被认为是新药研发领域中最重要,也是最有应用前景的药物靶点之一。
GPCRs在被配体激活后,主要通过下游的G蛋白或arrestin通路行使特定的生理功能。然而,GPCRs在招募arrestin蛋白之前,必须被GPCR激酶(GPCR Kinases,GRKs)识别和调控。GRKs能够磷酸化GPCRs,促进其招募arrestin蛋白,抑制其招募G蛋白,GRKs被认为是调控GPCR两条信号通路转换的关键分子。因此,在整个GPCR信号转导领域存在三个最为关键的科学问题,分别是:1)GPCRs如何识别和招募下游G蛋白;2)GPCRs如何识别和招募下游arrestin蛋白;3)GPCRs如何被GRKs识别和调控。
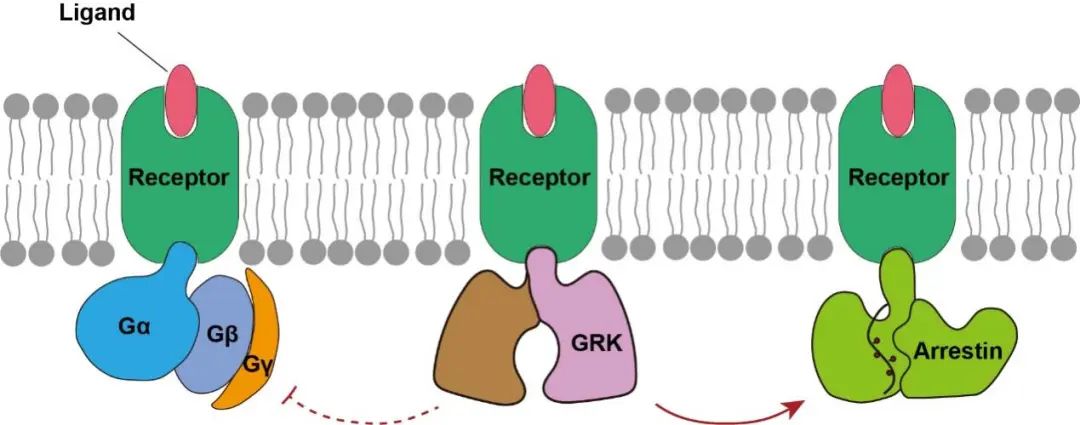
图1 GPCRs信号转导领域最关键的三个科学问题
2011年,斯坦福大学Brian K. Kobilka实验室解析了第一个GPCR——β肾上腺素能受体与Gs蛋白的复合物晶体结构,揭示了GPCR与G蛋白识别的分子基础 (Rasmussen et al., 2011)。Brian K. Kobilka也因在GPCR研究领域的突出贡献与他的博士导师Robert J. Lefkowitz共同获得了2012年的诺贝尔化学奖。2015年,徐华强课题组利用自由电子激光首次解析了人视紫红质蛋白rhodopsin与arrestin1的复合物结构,揭示了GPCR与arrestin蛋白识别的分子基础 (Kang et al., 2015),并在之后进一步解析了GPCRs招募arrestin蛋白的磷酸化密码 (Zhou et al., 2017)。然而,由于GPCRs与GRKs的结合短暂且高度动态,想要获得稳定的GPCR-GRK复合物非常困难,这使得有关GPCRs与GRKs的结构与功能研究进展缓慢。
早在十年前,徐华强课题组便展开了GPCR与GRK复合物的结构研究工作,然而,鉴于GPCR与GRK之间的微弱相互作用,阻碍了进一步的结构研究,因此,亟待建立新的技术手段或方法来克服复合物不稳定的难题。2017年,徐华强课题组和斯坦福大学Brian K. Kobilka实验室均通过借助大量的生化实验,分子模拟,细胞试验等提出了GPCR识别GRK的分子模型,相关成果分别发表于Cell Research 和Cell (He et al., 2017; Komolov et al., 2017)。
直到2021年,普渡大学John J. G. Tesmer实验室在Nature上报道了第一个GPCR——视紫红质蛋白rhodopsin与GRK1的复合物冷冻电镜结构 (Chen et al., 2021),首次揭示了视觉GPCR识别GRK1的模式,然而,由于复合物整体密度较差,GRK1只有催化结构域能被确定,且受体与GRK1相互作用界面的分子基础仍不清晰。
另一方面,GPCRs作为一类重要的药物靶标,越来越多的研究发现,GPCR的两条信号通路,G蛋白和arrestin通路,与靶向GPCRs的药物分子的疗效和副作用密切相关。相比于传统的GPCR激动剂或抑制剂能够同时激活或抑制GPCR的两条信号通路,选择性激活(即偏向性激动剂)GPCR其中一条通路的药物分子往往具有更好的疗效和更低的副作用,因此,开发偏向性药物分子是靶向GPCR药物研发的重要趋势。然而,截至目前,绝大多数偏向性激动剂均是通过偶然筛选发现的,且作用机制不明确。GRKs是调控GPCR两条信号通路转换的关键分子,GRKs也被认为是靶向GPCR偏向性药物分子发现的关键一环。研究GRKs识别和调控GPCRs的分子机制,揭示偏向性激动剂介导GPCR的偏向性信号转导机制,对于靶向GPCR的偏向性药物发现具有十分重要的科学意义。
2023年8月2日,中科院上海药物研究所徐华强研究员、段佳研究员和杨德华研究员共同在Nature 杂志上发表了最新研究成果“GPCR activation and GRK2 assembly by a biased intracellular agonist”,在国际上报道了第一个高分辨率GPCR——神经降压素受体(neurotensin receptor 1,NTSR1)与GRK2的复合物结构,揭示了GRK2识别和调控GPCR的详细分子机制,并通过结构解析,首次发现了一个全新的GPCR偏向性配体结合口袋,为临床开发靶向GPCR的偏向性药物分子开辟了全新的思路和途径。

人体内有7种GRKs亚型,GRK1/7主要在视觉系统发挥功能,GRK2/3/4/5/6在非视觉系统发挥功能,其中,GRK2和GRK5是参与调控GPCRs功能最主要的两种GRKs亚型。7种GRKs负责调控800多种GPCRs的功能,GPCRs与GRKs的微弱相互作用是阻碍GPCR-GRK复合物结构研究的最大难点。因此,在开展此项研究时,论文第一作者兼通讯作者段佳研究员主要通过以下四种策略获得了稳定的GPCR-GRK复合物从而实现了结构解析。
1)选择合适的研究对象。不同的GPCRs与GRKs的结合能力不同,作者首先通过建立Tango assay平台,用于评估受体与GRK之间的相互作用强弱,继而通过大量筛选,发现NTSR1是与GRK2相互作用最强的受体,因此选择NTSR1作为研究对象。
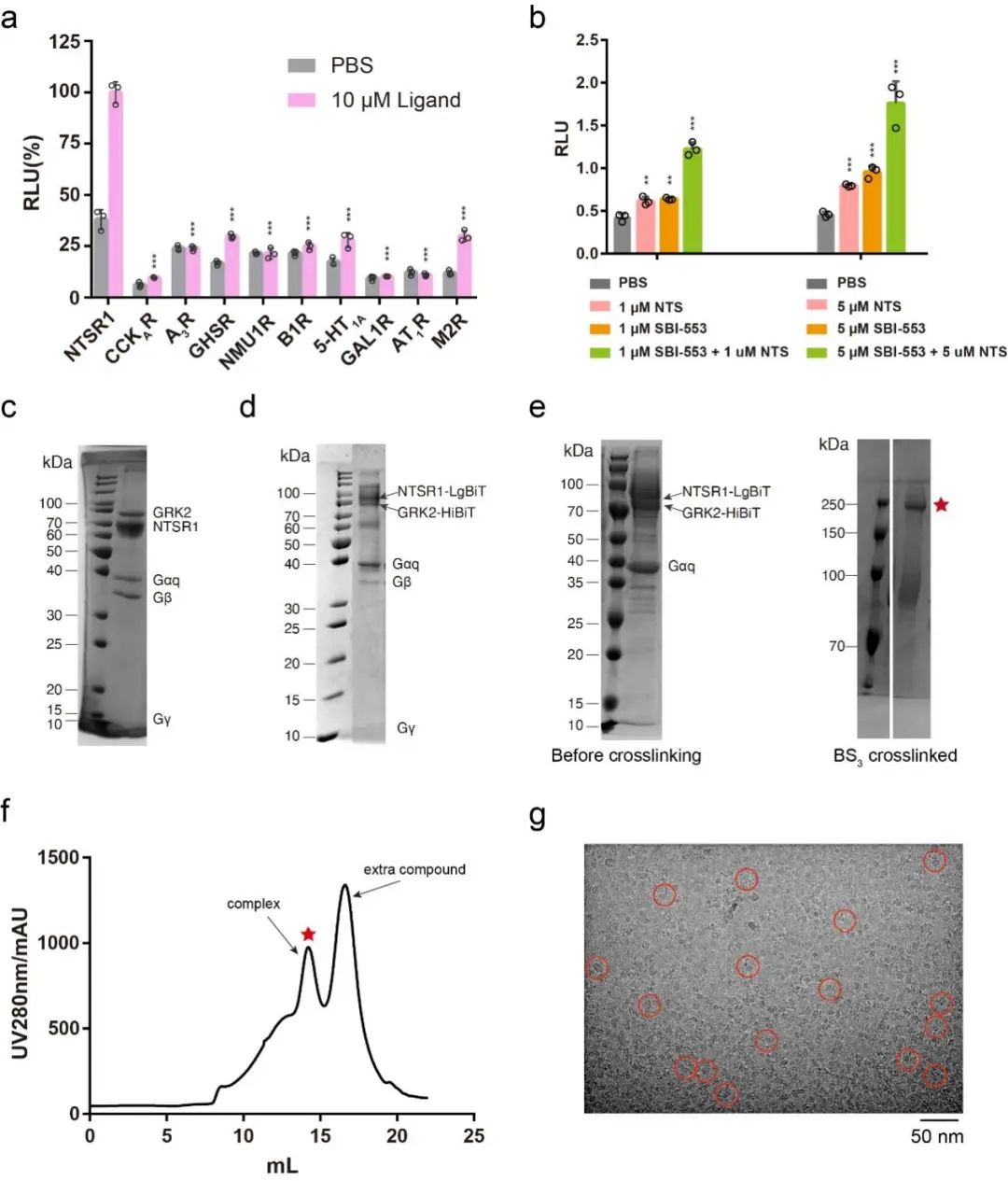
图2 Tango assay的部分筛选结果。
所有受体均使用内源性配体激活或者使用PBS作为对照,配体的使用浓度为10 μM,从图上可以看出NTSR1被激活后与GRK2的结合信号最强。
NTSR1是一种典型的A类GPCRs,其通过内源性神经降压素(NTS)介导神经传递和调节,广泛参与调控人体血压、血糖、体温、镇痛、神经元损伤等。NTSR1主要被GRK2和GRK5识别和调控。据报道,NTSR1是治疗成瘾、肥胖、镇痛、癌症、帕金森病和精神分裂症的一个重要药物靶标。
2)引入NTSR1偏向性激动剂SBI-553。据报道,SBI-553能够偏向性激活NTSR1的arrestin通路,能够在治疗成瘾行为时,有效地避免低血压、体温过低和运动障碍等不良副作用的发生,但其具体的作用机制未知 (Slosky et al., 2020)。在本项研究中,作者首次发现,SBI-553不仅能够直接激活受体招募下游arrestin蛋白,也能够直接引起受体招募GRK2,且SBI-553与NTS联用能够进一步提高受体招募GRK2的能力,因此,本项研究中通过同时引入SBI-553和NTS共同激活受体进行复合物的组装。
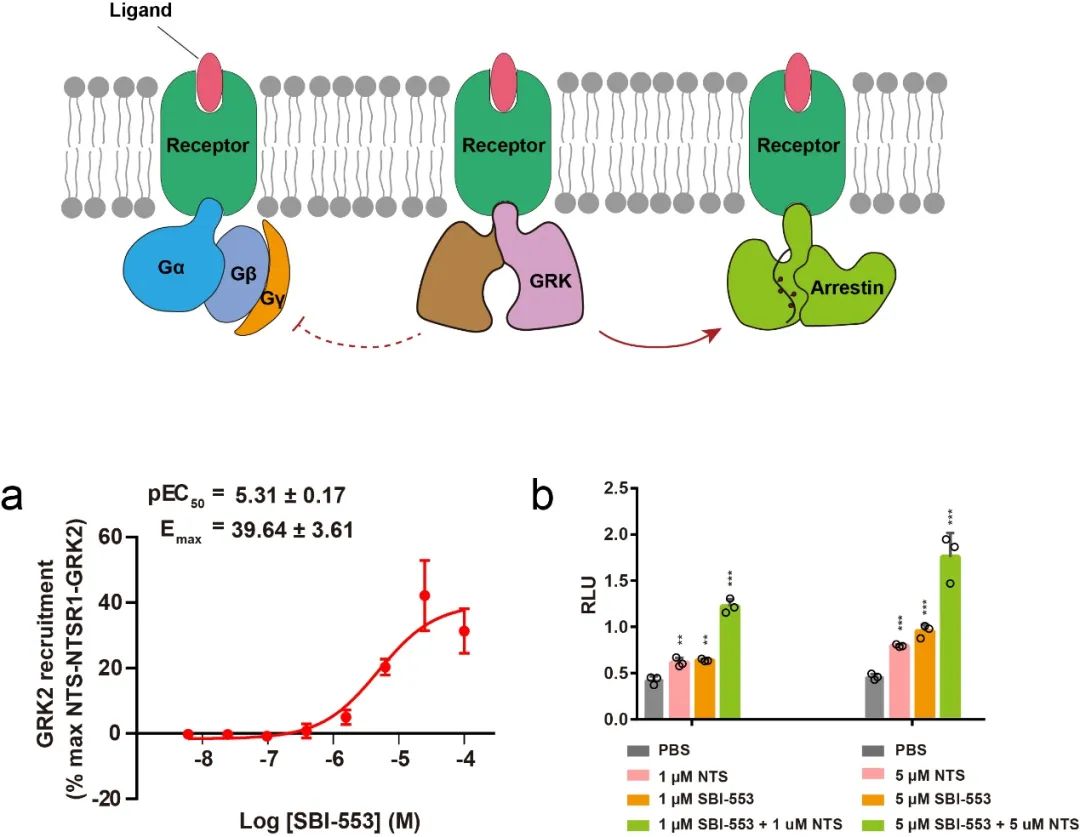
图3 SBI-553激活NTSR1招募下游GRK2。 a,NanoBiT招募实验结果显示SBI-553能够激活NTSR1并促进GRK2的招募;b,Tango assay实验结果显示NTS与SBI-553联用能够进一步增强受体招募GRK2的信号。
3)引入NanoBiT交联技术。NanoBiT方法是一种经典的用于检测蛋白-蛋白相互作用的方法,NanoBiT系统主要基于结构互补,包含两个蛋白亚基,LgBiT和SmBiT。此前,段佳研究员博士期间通过对NanoBiT方法进行改造,开创性的将该方法引入到稳定GPCR与G蛋白信号转导复合物的组装过程中,成功的解决了GPCR与G蛋白信号转导复合物不稳定的技术难题,相关成果于2020年发表于Nature Communications (Duan et al., 2020)。截至目前,该方法已被成功应用于解析近100个GPCR-G蛋白复合物结构,该方法极大地推动了整个GPCR结构研究的高速发展。
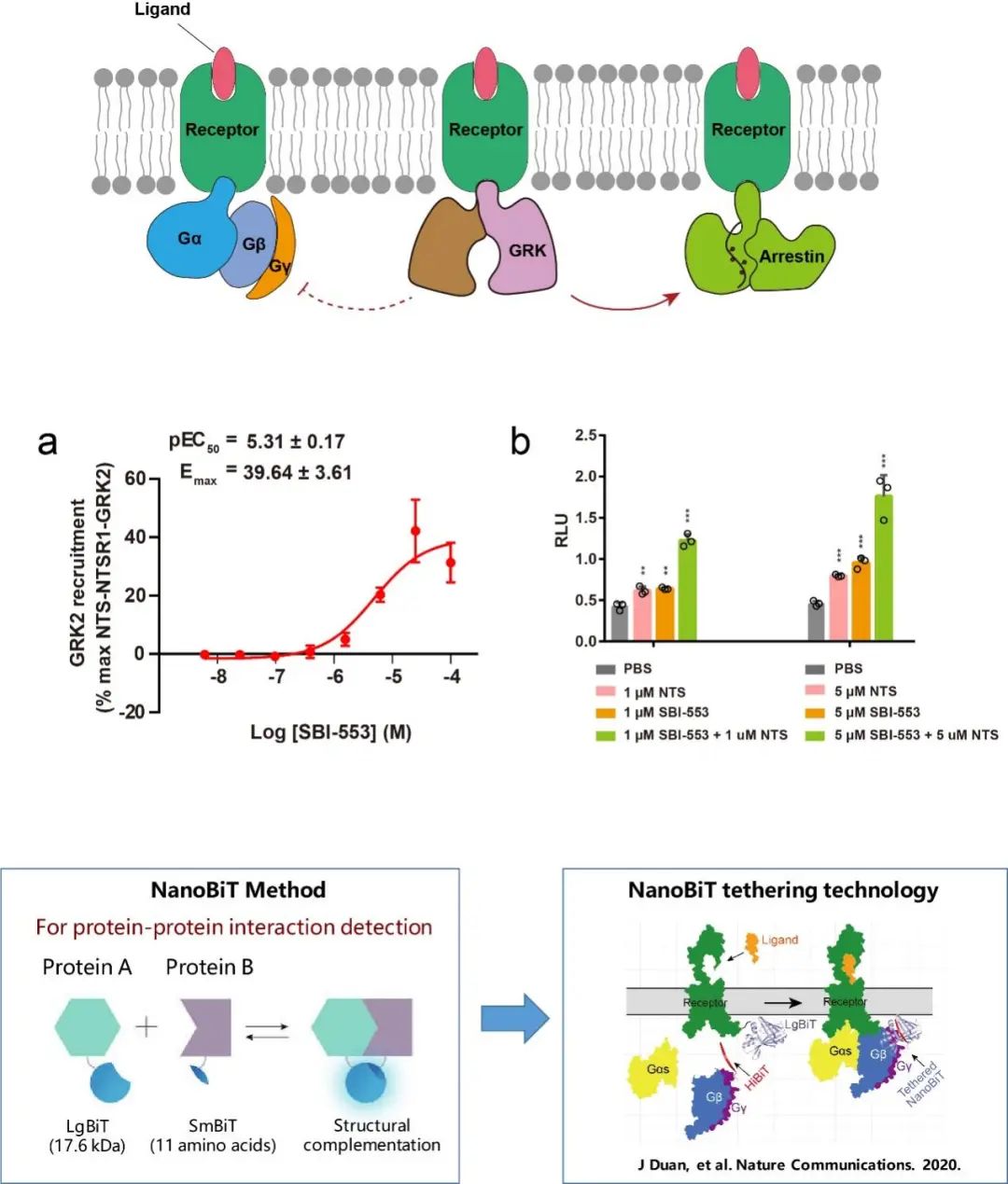
图4 经典NanoBiT方法与NanoBiT交联技术基本原理
在本项研究中,作者通过引入NanoBiT方法,进一步促进复合物的组装效率、提高复合物的稳定性。通过条件筛选和优化,作者发现,在受体的C末端接上LgBiT,在GRK2的C末端接上SmBiT(定义为HiBiT),能够获得均一、稳定的复合物蛋白,然而,进一步的冷冻电镜数据收集及处理发现复合物仍未达到能够结构解析的标准。
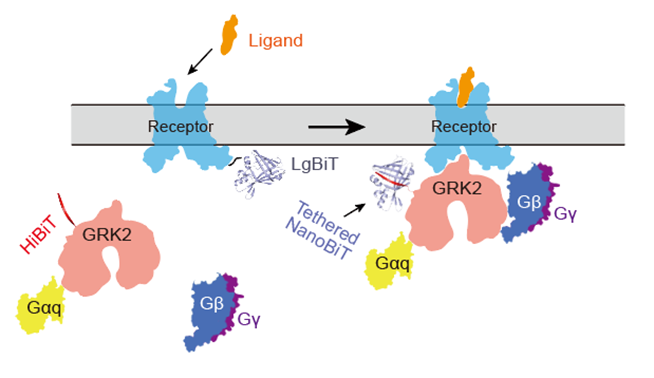
图5 NanoBiT交联技术应用于NTSR1-GRK2复合物组装的基本策略
4)采用化学交联技术。为进一步稳定复合物构象,作者尝试对复合物蛋白进行化学交联。通过文献调研,以及分析受体NTSR1和GRK2的结构特征,作者猜测受体和GRK的作用界面之间存在较多的赖氨酸,因此重点考虑基于K-K的交联方式。进一步的筛选作者确定了BS3是最合适的交联剂,并对复合物进行了有效的化学交联。
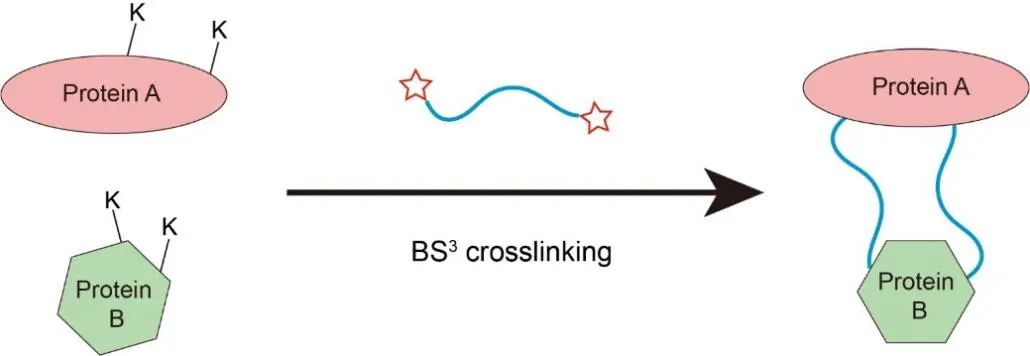
图6 基于K-K化学交联的基本原理
通过结合上述一系列技术手段,作者最终成功解析了第一个高分辨率GPCR与GRK2的复合物结构,揭示了近几十年来GPCRs信号转导领域遗留的最为关键的一个科学问题。结合细胞水平的突变实验,本研究首次阐明了GRK2识别和调控NTSR1的详细分子机制,考虑到GPCRs结构的相似性和保守性,该机制同样可拓展于其他GPCRs。通过结构解析,本研究也首次揭示了SBI-553作用于NTSR1的受体口袋,并发现了SBI-553通过直接占据G蛋白的结合位置从而实现了arrestin偏向性激动的分子基础。
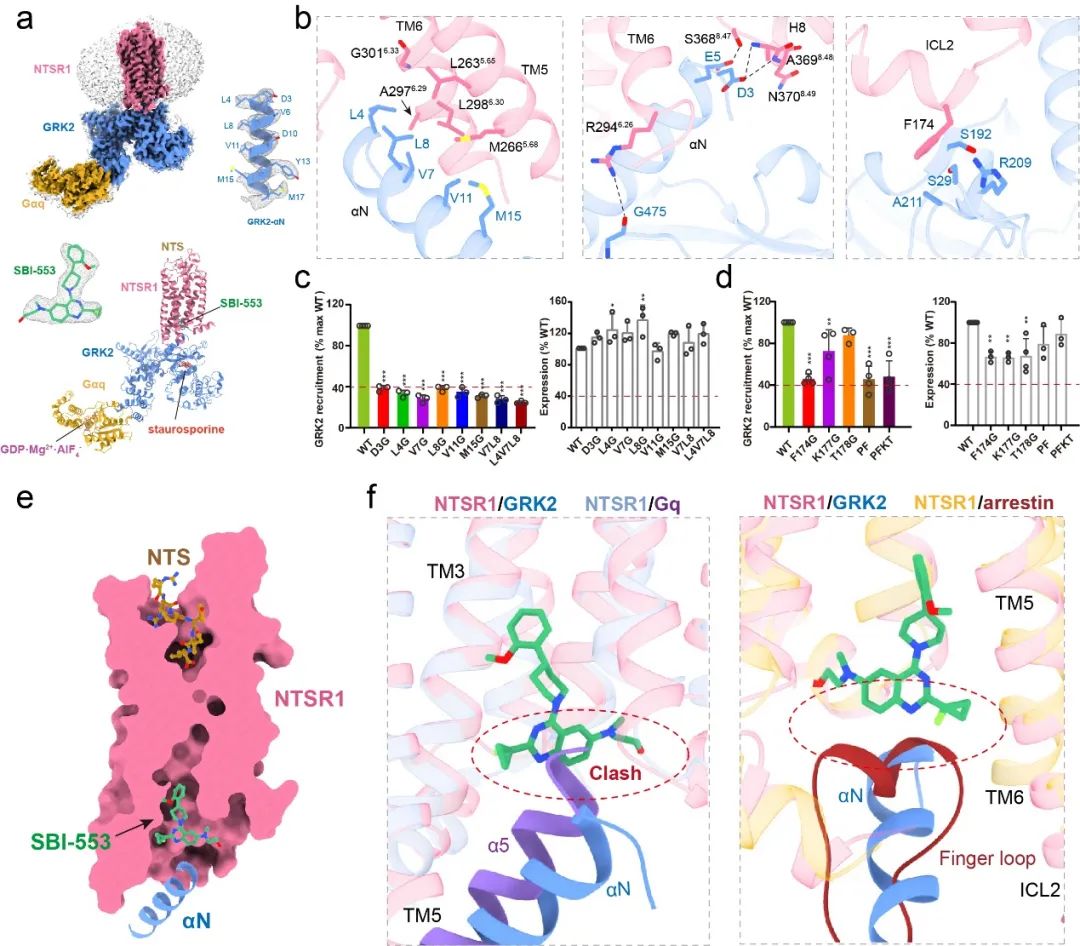
图7 NTSR1-GRK2结构特征。
a,NTSR1-GRK2复合物电子密度图和模型图,GRK2-αN是受体与GRK相互作用的主要界面,从图中可以看出GRK2-αN的密度非常清晰,SBI-553的密度也非常清晰;b,NTSR1与GRK2相互作用界面的详细分子基础;c-d,细胞水平的点突变实验验证NTSR1与GRK2相互作用的关键氨基酸残基;e,SBI-553在受体中的结合口袋;f,NTSR1-Gq复合物、NTSR1-arrestin复合物及NTSR1-GRK2复合物结构比较,结果显示,SBI-553与arrestn和GRK2的结合位置不存在冲突,但与Gαq结合的位置存在明显的空间位阻,从而拮抗受体招募Gq蛋白,实现arrestin的偏向性激活。
徐华强课题组长期专注于生物大分子复合物的结构解析及功能研究,特别是在GPCRs信号转导复合物的研究中积累了大量的经验,本项研究也正是课题组前十年的研究基础上,通过进一步发展NanoBiT交联技术及化学交联等一系列手段和技术,首次成功解析了高分辨率的GPCR-GRK复合物结构,揭示了GPCR信号转导领域现存的一个最为关键的科学问题,即GPCRs如何受GRKs识别和调控,这一成果是细胞信号转导教科书级别的原创性成果。
GPCRs与GRKs的微弱相互作用和高度动态使得传统的X-射线晶体学无法实现结构解析,本项研究中使用的多种技术方法结合单颗粒冷冻电镜技术将为今后研究其他生物多元动态复合物提供重要的启发和指导依据,从而推动整个生物大分子多元动态复合物研究的进程。
令人十分意外的是,本项研究中首次揭示了SBI-553结合于受体胞内侧的疏水口袋中,与此前所报道的所有小分子结合口袋均不同,这为今后开发靶向GPCRs的新型偏向性药物开辟了全新的思路和途径。本研究也首次阐明了SBI-553实现偏向性激活受体arrestin通路的结构机制,值得一提的是,徐华强课题组7月31号在Nature上报道了B类GPCRs的新型G蛋白偏向性小分子激动剂,揭示了G蛋白偏向性配体的作用机制,结合本项研究,两项研究首次全面系统地揭示了两种不同类型的偏向性激动剂介导受体偏向性信号转导的详细分子机制,极大地促进了我们对GPCRs偏向性信号转导的理解与认识,为今后开发靶向GPCRs的偏向性药物分子提供了夯实的结构基础。
中科院上海药物研究所段佳研究员、刘恒博士、赵丰辉博士为本论文共同第一作者。中科院上海药物研究所徐华强研究员、段佳研究员和杨德华研究员为共同通讯作者。上海市高峰电镜中心执行主任袁青宁对数据的收集及处理提供了大量的帮助。该工作得到国家重点研发计划、上海市市级科技重大专项、科技部重点研发计划、中科院战略性先导科技专项、国家自然科学基金委等项目的资助。
文章来源“iNature”