癌症细胞接受细胞外信号输入以获得干性样状态,然而肿瘤微环境(TME)神经信号如何引导癌症干性建立分级肿瘤结构尚不清楚。
2023年7月19日,中山大学刘强及王曦共同通讯在Signal Transduction and Targeted Therapy在线发表了题为“Cancer cell employs a microenvironmental neural signal trans-activating nucleus-mitochondria coordination to acquire stemness”的研究论文,该研究揭示癌细胞利用微环境神经信号反式激活细胞核-线粒体协调来获得干性。该研究对33种TCGA癌症类型的10,852个样本进行泛癌转录组学筛查,发现cAMP应答元件(CRE)转录因子是癌症干性的聚合激活剂。转录组图谱的反褶积、神经标记物的规范和去甲肾上腺素动力学的说明揭示了TME神经信号和癌细胞CRE活性之间的联系。
具体来说,神经信号去甲肾上腺素通过激活cAMP-CRE轴增强近端癌症细胞的干性,其中ATF1是一个保守的中枢。在去甲肾上腺素的激活下,ATF1通过协调反式激活核多能因子MYC/NANOG和线粒体生物生成调节因子NRF1/TFAM,从而协调核重塑和线粒体再生,增强癌症干性。因此,单细胞转录组证实了癌症干样细胞核多能性与线粒体生物生成的协调激活。总之,这些发现阐明,癌细胞是通过去甲肾上腺素-ATF1驱动的细胞核-线粒体协作程序获得干性的,这表明干性的获得是通过劫持微环境神经信号实现的空间化。

癌症干性具有克隆原性、自我更新和多系分化的特性,目前是一种功能定义的可塑性细胞状态。癌症干样状态的可塑性表明,需要细胞外输入通过细胞内因子和外因子之间的复杂相互作用来指示干性。控制正常干细胞命运的多功能转录因子是癌症干样细胞(CSCs)的核心内在调节因子。MYC等转录因子在多种癌症(包括乳腺癌和胰腺癌)中驱动干性。来自肿瘤微环境(TME)的细胞外细胞因子,如TGF-β、IL-6,足以启动干样状态。
在TME因素中,神经信号被越来越多地认为有助于癌症的进展。例如,已发现去甲肾上腺素、γ-氨基丁酸和谷氨酸可导致侵袭性癌症表型,这表明癌症干样特性。事实上,TME神经信号最近被认为是连接心理状态和癌症进展的信号中枢。然而,关于TME定位的神经信号如何与细胞内固有干性因子结合以建立癌症干样状态,人们知之甚少。
神经递质是参与癌症发展的广受欢迎的神经信号。在神经递质中,肾上腺素能信号诱导的去甲肾上腺素在癌症进展中起着重要作用。去甲肾上腺素激活的肾上腺素受体调节跨膜腺苷酸环化酶的活性,该酶产生3',5'-环磷酸腺苷(cAMP)以控制细胞对神经信号的反应。对cAMP的转录反应主要依赖于蛋白激酶A(PKA),其磷酸化并激活cAMP反应元件(CRE)结合转录因子CREB/ATF1(激活转录因子1)以控制靶基因转录。
因此,CRE结合转录因子对于细胞对慢性应激诱导的肾上腺素能神经递质的反应至关重要。然而,肾上腺素能信号诱导的CRE信号对癌症干性的作用机制尚不清楚。CDK5-CREB1增强胶质瘤干细胞和AMPK-CREB1增强胶质母细胞瘤干细胞的发现表明cAMP反应程序在干性中的作用。最近一项针对转移性结直肠癌的研究证实,cAMP-CREB1信号传导增强了癌症干性。然而,癌症细胞是否通过TME神经信号依赖的CRE程序获得干性尚不确定。
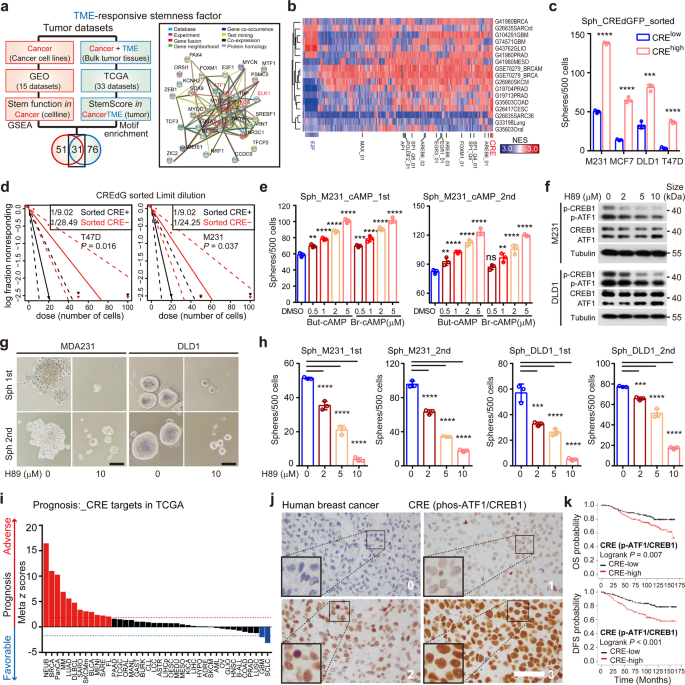
CRE 是一种泛癌症 TME 反应性干性效应因子(图源自Signal Transduction and Targeted Therapy )
该研究根据33种TCGA癌症类型的10,852个肿瘤和11种癌症类型的17对粘附分子的干性转录谱来表征泛癌TME反应性干性转录因子。在TME反应性干性因子中,CRE因子被保守地富集,并且在多种癌症类型中需要干样功能。肿瘤细胞成分、免疫荧光和延时荧光成像的反褶积揭示了TME神经信号和癌细胞CRE活性之间的联系。具体而言,微环境去甲肾上腺素是一种被慢性应激激活的肾上腺素能神经递质,通过cAMP-ATF1轴增强近端癌症细胞的干性活性。ATF1通过同时协调核多能性和线粒体再生相关基因的反式激活,整合肾上腺素能信号和细胞内固有干性因子,从而将癌症细胞推向干样状态。
文章来源“iNature”







