近日,一篇发表在国际杂志Nature上题为“DHODH inhibitors sensitize to ferroptosis by FSP1 inhibition”的研究报告中,来自德国慕尼黑赫姆霍兹中心等机构的科学家们通过研究揭示了一种特殊机制,其或能通过药理性靶向作用一种铁死亡监测系统(ferroptosis surveillance system)来促进癌细胞发生死亡。
铁死亡是一种受调控的氧化性细胞死亡形式,近年来其引起了科学家们极大的研究兴趣,因为其在标准的疗法耐受性和转移性癌症的治疗中表现出了一定的药理学可操控性,因此,通过药理学靶向作用内源性的防御系统来调节细胞对铁死亡的敏感性如今渐渐成为了一种非常有前途的抗癌疗法策略。科学家们发现,二氢鸟嘌呤脱氢酶(DHODH,dihydroorotate dehydrogenase)抑制剂引起的铁死亡敏感效应是通过抑制铁死亡抑制蛋白-1(FSP1, ferroptosis suppressor protein-1)来发生的,FSP1是研究人员早先识别出的另一种铁死亡参与者,而并不是通过DHODH本身来发生的,这些研究发现证实了FSP1在癌细胞铁死亡监督过程中的重要角色,其或能推动FSP1抑制剂作为有效癌症疗法的未来发展和进步。
促使细胞敏感并经历以铁死亡形式的受调控细胞死亡或许是一种新型的抗癌疗法形式,尤其是考虑到标准疗法的耐受和转移性癌症;因此,目前研究人员正在深入研究能调节癌症铁死亡敏感性的新型细胞机制和化合物,2021年,DHODH就被描述为新型的铁死亡抑制剂。DHODH是一种定位于线粒体的特殊酶类,其因能通过氧化二氢乳清酸(dihydroorotate)同时减少线粒体中辅酶Q10(CoQ10)从而产生用于DNA合成的基本元件而闻名,基于最近的数据,DHODH的强效和选择性抑制剂(比如brequinar)能有效促使癌细胞对铁死亡敏感,因此其或能扮演铁死亡的抑制子。
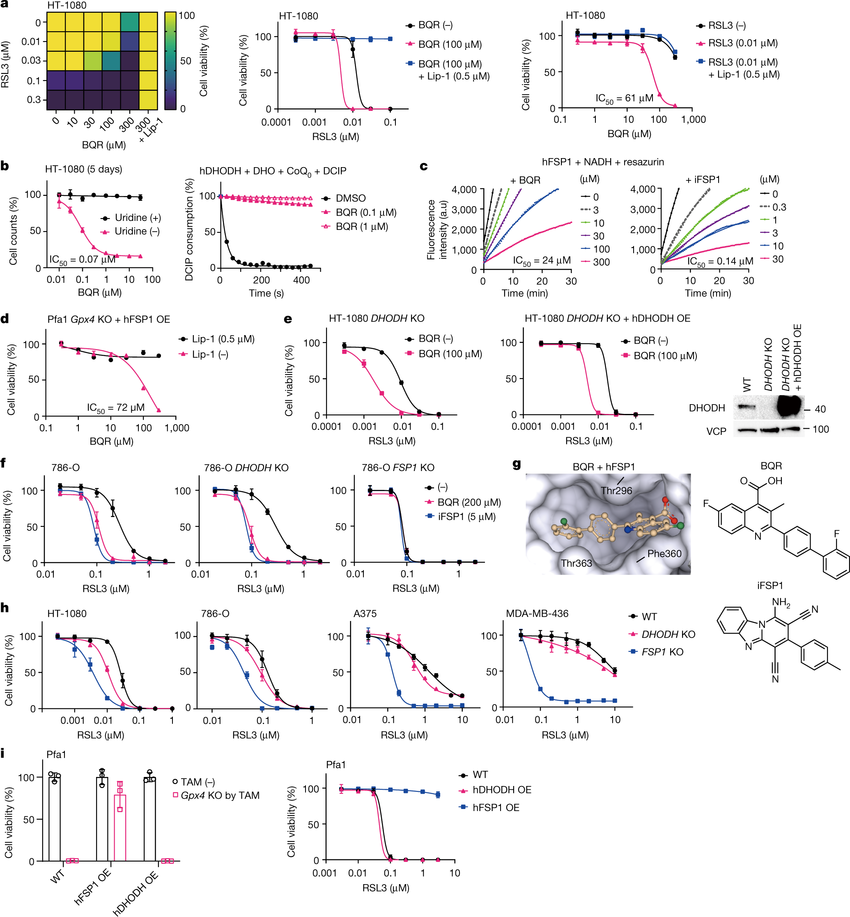
科学家揭示促进癌细胞对铁死亡易感背后的特定分子机制。图片来源:Nature (2023). DOI:10.1038/s41586-023-06269-0
因此,DHODH的抑制作用被认为是一种能克服癌细胞对铁死亡耐受的潜在靶点,研究者Marcus Conrad说道,如今我们阐明了高浓度的DHODH抑制剂是如何通过铁死亡来促进癌细胞发生死亡的;DHODH拥有与FSP1类似的功能,这两种蛋白都能减少CoQ10从而防止脂质的过氧化,而研究者推测,DHODH抑制剂或许能靶向作用FSP1。
研究人员还调查了是否DHODH抑制剂所产生的铁死亡致敏效应能通过FSP1的抑制来介导,随后他们证实,诸如布喹那(brequinar)等DHODH抑制剂的确能够明显地抑制FSP1,此外,DHODH抑制剂的铁死亡致敏效应还能通过FSP1的抑制(而并非由DHODH自身)来介导;研究人员还得出证据表明,谷胱甘肽过氧化物酶4(GPX4,glutathione peroxidase 4)的较短形式(称之为细胞质和体细胞形式)或能有效保护细胞免于铁死亡,这与线粒体异构体相反。这些研究结果反驳了DHODH在铁死亡监督中的假定作用,而GPX4和FSP1仍然是抑制细胞(包括癌细胞)中铁死亡的主要系统。
由于难治性和转移性癌症对铁死亡高度敏感,通过FSP1促使癌细胞对铁死亡敏感或许就有望帮助开发新型抗癌药物;尽管临床上可获得的FSP1抑制剂目前正在开发中,但目前正在临床试验中进行测试的多种DHODH抑制剂或许能作为FSP1抑制剂的发现,或许有望帮助开发并推进FSP1抑制剂用于新型癌症疗法。最后研究者Marcus Conrad评论道,用体内可用的FSP1特定化合物来抑制FSP1或能作为一种有效的抗癌策略来治疗特定类型的人类癌症。
文章来源“生物谷”