肿瘤的突变负担和异质性已被认为是对许多靶向治疗产生耐药性的原因。胞嘧啶脱氨酶APOBEC蛋白与超过70%的人类癌症的突变特征有关。然而,癌细胞如何劫持APOBEC介导的突变机制以促进肿瘤异质性,从而促进治疗耐药性的机制尚不清楚。
2023年7月20日,德克萨斯大学西南医学中心牟平团队在Cancer Cell 在线发表题为“Loss of SYNCRIP unleashes APOBEC-driven mutagenesis, tumor heterogeneity, and AR-targeted therapy resistance in prostate cancer”的研究论文,该研究发现SYNCRIP是一种内源性分子制动器,可以抑制前列腺癌(PCa)中APOBEC驱动的突变。
在SYNCRIP缺失的PCa细胞中,过度激活的APOBEC3B是一个关键的突变子,代表了PCa中一些常见突变基因(包括FOXA1、EP300)驱动突变的分子来源。功能筛选确定了APOBEC3B突变的PCa中雄激素受体(AR)靶向治疗耐药的8个关键驱动因素:BRD7、CBX8、EP300、FOXA1、HDAC5、HSF4、STAT3和AR。这些结果揭示了APOBEC驱动的突变释放的细胞内在机制,该机制在赋予PCa AR靶向治疗耐药中起重要作用。

针对驱动癌基因的治疗方法的发展已经彻底改变了许多癌症的临床管理;然而,它们的反应的幅度和持续时间仍然是可变的,并且不可避免地发生抵抗。大量证据表明,突变负担的增加和遗传异质性既是抗性的燃料,也是抗性的来源。因此,阐明这种增加的诱变和遗传异质性的分子起源和机制对于培养下一代抗癌疗法和克服耐药性至关重要。
遗传异质性可能源于许多癌症的基因组不稳定性。新出现的数据表明,肿瘤细胞可以劫持稳态调节机制,从而加强突变,作为促进基因组不稳定的可能途径。这种机制的一个重要例子是脱氨酶APOBEC蛋白。在超过70%的人类癌症中观察到APOBEC驱动的突变模式增加。然而,癌细胞如何劫持APOBEC介导的突变机制以促进肿瘤异质性,从而促进治疗耐药性的机制在很大程度上仍然未知。
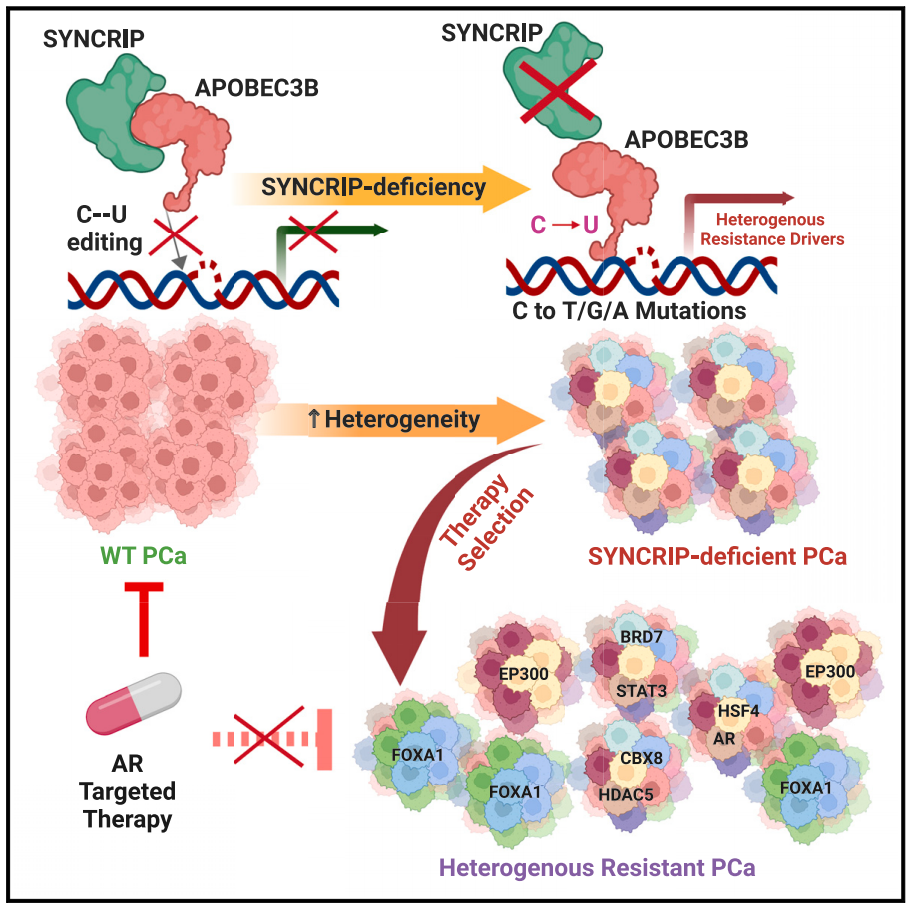
机理模式图(图源自Cancer Cell )
该研究发现前列腺癌(PCa)中突触结合细胞质RNA相互作用蛋白(SYNCRIP)的频繁丢失是一个分子驱动事件,释放APOBEC驱动的突变。在SYNCRIP缺失的肿瘤中,过度激活的APOBEC3B是PCa(包括FOXA1、EP300和AR)中频繁驱动突变的关键突变子和分子来源。
研究结果确定了8个由APOBEC3B失调引起的PCa雄激素受体(AR)靶向治疗耐药的关键驱动因素。与传统认识相反,单细胞转录组学分析显示,APOBEC3B诱导的FOXA1驱动突变胜过其他驱动突变,最终主导耐药肿瘤。总的来说,这些发现揭示了控制肿瘤突变负担和异质性的细胞内在机制,并将SYNCRIP和过度激活的APOBEC3B驱动的突变与经常观察到的赋予AR靶向治疗耐药性的驱动突变在机制上联系起来。
文章来源“iNature”