在人类中,每个细胞通常都有一对性染色体。男性有一条X染色体和一条Y染色体,而女人有两条X染色体。Y染色体已知对男性性别和精子形成至关重要。除此之外,研究人员在测序技术和CRISPR介导的整个Y染色体敲除技术的帮助下,逐渐开始理解Y染色体在各种生理环境下的功能。
最近的研究结果表明,在老龄男性中,Y染色体的丢失(Loss of the Y chromosome, LOY)与许多不利的健康后果有关。例如,造血细胞中的LOY与多种疾病的风险增加有关,包括心肌纤维化和多种癌症。其中,在膀胱癌中,在10~40%的肿瘤中发现了Y染色体丢失。
2023年6月21日,来自美国西达赛奈医学中心等单位的研究团队在国际顶级期刊 Nature发表了题为Y chromosome loss in cancer drives growth by evasion of adaptive immunity的文章,在该研究中,他们发现Y染色体的缺失使膀胱癌细胞能够躲避免疫系统并非常积极地生长,具有侵袭性表型,但不知为何同时也使肿瘤对免疫检查点抑制剂更加敏感。

图片来源:Nature
主要研究内容
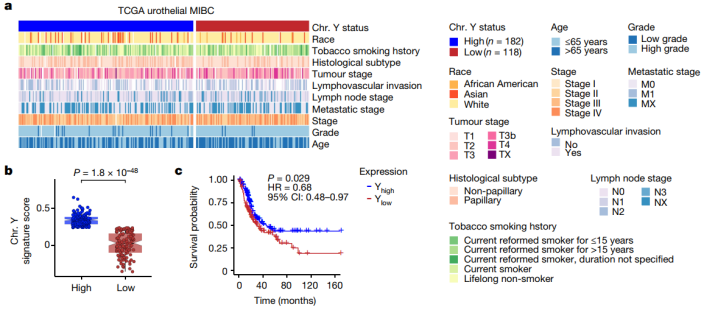
01 LOY与较差的患者预后相关
首先,研究人员基于正常膀胱尿路上皮中表达的18个Y编码基因创建了Y染色体 RNA表达特征评分基因集。他们在癌症基因组图谱(TCGA)转录组数据中使用该评分对300名局部晚期肌肉浸润性膀胱癌(MIBC)患者的总体生存率进行了分析。结果发现,根据平均Y染色体特征分数可以将样本分为两组:Yhigh和 Ylow,并发现Ylow与Yhigh相比,前者的总生存率显著降低。
图片来源:Nature
02 LOY对肿瘤生长的影响
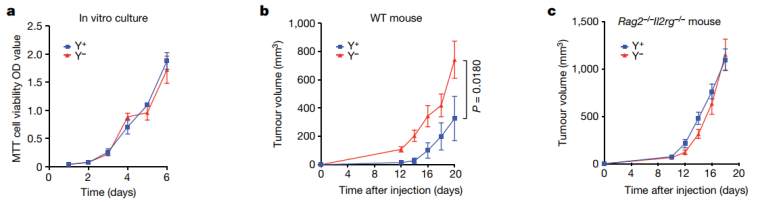
为了确定为什么Ylow比Yhigh肿瘤更具侵袭性,他们首先评估了MB49细胞系中Y 染色体基因的表达,MB49是一种经过充分研究的小鼠膀胱癌细胞系,已经被证明自然失去了Y染色体。随后,他们汇集了16个没有Y色体基因表达的克隆,以创建一个多克隆Y−细胞株;类似地,他们将16个表达4个Y染色体基因的克隆集中在一起,创建多克隆Y+细胞株。
在2D或3D离体培养中,他们观察到Y−和Y+之间的增殖没有差异。为了研究LOY 对体内肿瘤生长的影响,他们将Y−和Y+注射到具有免疫能力的野生型雄性小鼠皮下。他们发现,与Y+肿瘤相比,Y−肿瘤的生长速度增加了大约两倍。此外,在注射到免疫缺陷小鼠中时,他们发现在免疫受损的Rag2−/−Il2rg−/−(缺乏T细胞、B细胞和自然杀伤细胞)小鼠中,两种细胞类型的生长速度相同,这表明 Y−肿瘤在逃避抗肿瘤适应性免疫方面更有效。
图片来源:Nature
03 LOY癌细胞产生免疫抑制TME
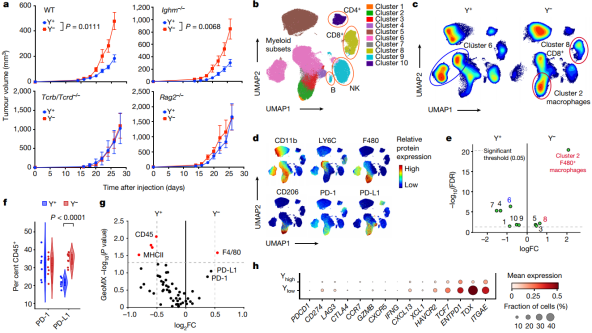
为了进一步确定Y−和Y+肿瘤生长差异的免疫学基础,他们对其进行了全转录组测序分析,共检测到958个差异表达基因。基因集富集分析(GSEA)结果显示,与 Y−肿瘤相比,Y+肿瘤与增强的免疫应答相关。
接下来,他们使用描述了肿瘤内CD45+免疫细胞群在Y+和Y−肿瘤之间的差异。结果发现,Y−肿瘤富集了CD8+ T细胞以及免疫抑制型巨噬细胞;而Y+肿瘤中的浸润巨噬细胞则具有更强的炎性表型。值得注意的是,PD-L1+CD45+免疫细胞的百分比和PD-L1表达水平在Y−肿瘤中增加。与这些发现一致的是,在Y− MB49组织切片中,他们也观察到F4/80+巨噬细胞数量增加和PD-1/PD-L1表达增加。
图片来源:Nature
04 LOY肿瘤对抗PD-1/PD-L1的反应
考虑到TME中耗竭型CD8+ T细胞的增加与抗PD-1/PD-L1免疫疗法的改善有关,他们使用抗PD-1阻断抗体治疗了相应的细胞株。与Y+肿瘤相比,Y−肿瘤模型均显示了对抗PD-1治疗的改善反应。值得注意的是,来自Y−肿瘤的D8+ T细胞对抗PD-1治疗表现出更强的表型反应:从更耗竭(表达TIM3、LAG3和TOX)到激活(表CD44、ICOS但不表达TOX)的分化状态。
为了确定上述临床前工作的人类相关性,他们评估了IMvigor210 atezolizumab (anti-PD-L1)临床试验中Ylow和Yhigh膀胱癌患者的总生存期。与细胞系治疗的改善反应一致,Ylow组膀胱癌患者在抗PD-L1治疗后有更好的结果。
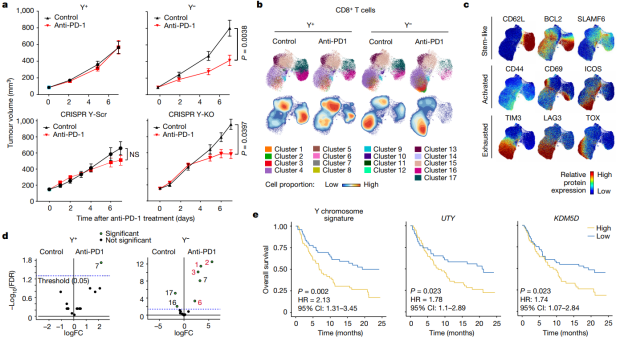
图片来源:Nature
如果根据Y染色体相关基因UTY或KDM5D的表达对患者进行分层,也会观察到类似的结果,这强调了这两个基因在确定LOY表型中的重要作用。
最近的一篇报道表明LOY和KDM5D的缺失导致造血干细胞和祖细胞基因组不稳定性增加。因此,他们还评估了不同类型肿瘤中DNA复制和修复途径的激活。
结果表明,与DNA损伤修复、错配修复和核苷酸切除修复等途径相关的标记物在 Ylow肿瘤中表达更高,这表明这些肿瘤确实在基因组上更不稳定。对该队列 Ylow和Yhigh膀胱癌的进一步遗传学评估显示,Ylow的肿瘤新抗原负担增加,这可能是导致其对ICB反应增加的原因。
总之,这些结果表明,膀胱肿瘤细胞中的Y染色体缺失有助于Ylow膀胱癌的侵袭性,这可以归因于表达PD-L1的巨噬细胞的增加导致T细胞免疫的有效逃避,并导致CD8+ T细胞耗竭。与LOY肿瘤促进TME中CD8+ T细胞衰竭一致,他们还发现 Y−肿瘤对抗PD-1 ICB反应更强烈,这也强调了该研究结果的临床意义。
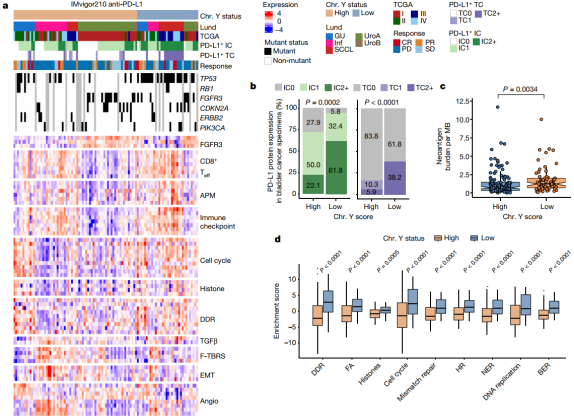
图片来源:Nature
结语
综上所述,在该研究中,他们报道了LOY与膀胱癌患者的不良预后相关,并发现LOY的癌细胞可以改变细胞功能,促进T细胞耗竭,并使它们对PD-1靶向免疫治疗敏感性增加。因此,这项工作为LOY突变的基本生物学和改善癌症免疫治疗的潜在生物标志物提供了新的见解。
本研究通讯作者、西达赛奈医学中心癌症研究所主任Dan Theodorescu教授说到:「这项研究首次将Y染色体的丢失与免疫系统对癌症的反应之间建立了以前从未有过的联系。我们发现,Y染色体的缺失会让膀胱癌细胞避开免疫系统,迅速生长。事实上,我们只有在免疫系统发挥作用时才会看到生长速度的差异,这是膀胱癌中『Y缺失』效应的关键。缺少Y染色体的肿瘤虽然更具攻击性,但也更脆弱,对免疫检查点抑制剂更敏感。」
Dan Theodorescu还补充道:「意识到Y染色体丢失的重要性,将会激发关于在人类生物学的所有科学研究中将性别作为一个变量的重要性的讨论。我们在这里提供的基本新知识可以解释为什么某些癌症在男性或女性中更糟糕,以及如何最好地治疗它们。它还表明,Y染色体不仅仅决定人类的生物学性别。」
本文转载自“丁香学术”
参考文献:
[1]Hany A. Abdel-Hafiz Y. et al. chromosome loss in cancer drives growth by evasion of adaptive immunity. Nature (2023).
[2]Sano, S. et al. Hematopoietic loss of Y chromosome leads to cardiac fibrosis and heart failure mortality. Science 377, 292–297 (2022).
[3]Kwon, H. et al. Androgen conspires with the CD8+ T cell exhaustion program and contributes to sex bias in cancer. Sci. Immunol. 7, eabq2630 (2022).