自2012年CRISPR-Cas9技术问世以来,基因编辑便驶入了快车道,取得了一系列新突破。如果将CRISPR-Cas9比作能够破坏目标基因的分子剪刀,那么base editor(碱基编辑器)可以称为分子铅笔,因其能对单个核苷酸进行替换。2019年开发的prime editor则具有更强大的功能,能够对基因组进行搜索和替换,堪称分子世界的“文字处理器”。
开发这些技术的最终目标是修复人类基因中的有害突变。16,000多个小的缺失变异与人类疾病存在因果关系,理论上可以通过插入缺失的序列来修复。囊性纤维化就是一个很好的例子,70%的病例由三核苷酸缺失而引起。
为了实现临床应用,人们需要一种技术来准确、高效且安全地插入序列,避免出现意外的结果。prime editing系统虽然在治疗囊性纤维化等遗传病上表现出巨大潜力,但目前仍不清楚哪些因素决定了编辑效率。
英国Wellcome Sanger研究院和爱沙尼亚塔尔图大学的研究人员近日在Nature Biotechnology杂志上发文称,他们开发出一种新工具,可预测将基因编辑的DNA序列成功插入基因组的几率。

影响插入效率的多个因素
在这项研究中,研究人员试图系统评估插入序列的长度和组成、细胞系、目标位点以及prime editor的不同版本如何影响插入效率。
为此,他们共设计了3,604条pegRNA,编码切口位点上游的插入物,这些插入物的长度从1nt到69nt不等,且GC含量不同。他们将序列插入两个细胞系(HEK293T和HAP1细胞)中,靶向四个目标位点(HEK3、EMX1、FANCF和CLYBL)。一周后,他们对这些细胞进行基因组测序,观察编辑是否成功。评估插入效率的整体策略详见图1。
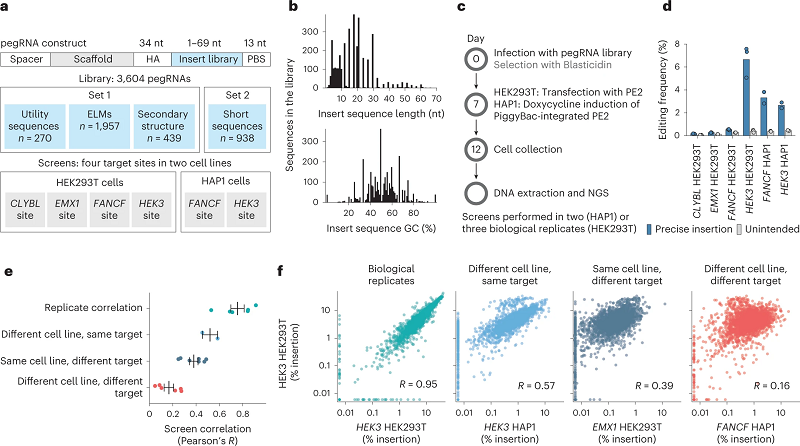
图1 prime插入效率的高通量测定
由于插入率的变化跨越了三个数量级,于是研究人员试图了解相关的特征,首先是插入物的长度。他们在HEK293T细胞中发现了两个特点:3和4nt序列的插入率高于其他序列;15-21nt序列的插入率高于周围的序列。不过在HAP1细胞中,1-4 nt短序列的插入率并没有高于较长序列。他们将其归因于错配修复(MMR)系统,因为HEK293T细胞在MMR上存在部分缺陷。敲除错配修复基因MLH1的HAP1细胞也证明了这一点,表明MMR系统阻碍了短序列的插入。
之后,他们分析了prime editing的不同步骤如何影响序列的插入率。他们发现,若pegRNA中带有四个或更多的连续腺嘌呤,则插入率会大大下降。此外,prime editing中的另一个重要步骤是带有5’ flap(包含野生型序列)和3’ flap(包含插入物)的中间产物之间达到平衡,而5’ flap核酸酶FEN1及3’ flap核酸酶TREX1和TREX2介导了这种平衡。他们发现,3’ flap核酸酶TREX1和TREX2抑制了较长序列的插入。
同时,插入序列的核苷酸组成和二级结构也会影响插入率。研究人员发现,prime editing系统对胞嘧啶有着明显的偏好。插入序列中每增加1%的胞嘧啶,则插入率平均增加2.2%。相反,腺嘌呤和胸腺嘧啶的百分比则降低了各个位点的插入率。此外,他们还发现,结构强度更高的序列能够被更有效地插入。
在此过程中,他们使用了Twist Bioscience提供的寡核苷酸池。据Twist介绍,他们独特的硅基DNA合成平台能够在单次运行中生成超过一百万条寡核苷酸,对数量几乎没有限制,而且寡核苷酸池精准均一,让人们对实验结果充满信心。此外,实验中使用的多个载体和基因片段也是由Twist Bioscience提供的。
预测不同序列的插入率
在了解影响插入率的多个因素后,研究人员接下来想预测不同序列在同一位点的插入效率。他们采用了机器学习的方法,挑选出10个特征来训练数据,包括插入序列的长度、组成、pegRNA二级结构和MMR等。这种称为MinsePIE的方法能够很好地预测测试数据的插入效率,相关性达到0.68(图2)。
在现有数据上进行训练后,他们在新数据上测试MinsePIE模型,发现它能够准确预测多个插入序列的成功率。之后,他们还对预测的序列进行实验测试。与预测插入率较低的变体相比,预测插入率较高的密码子变体确实表现出较高的插入率,这凸显了MinsePIE模型在密码子优化方面的优势。研究人员认为,这种计算模型可以帮助人们选择出最有效的序列写入基因组中。
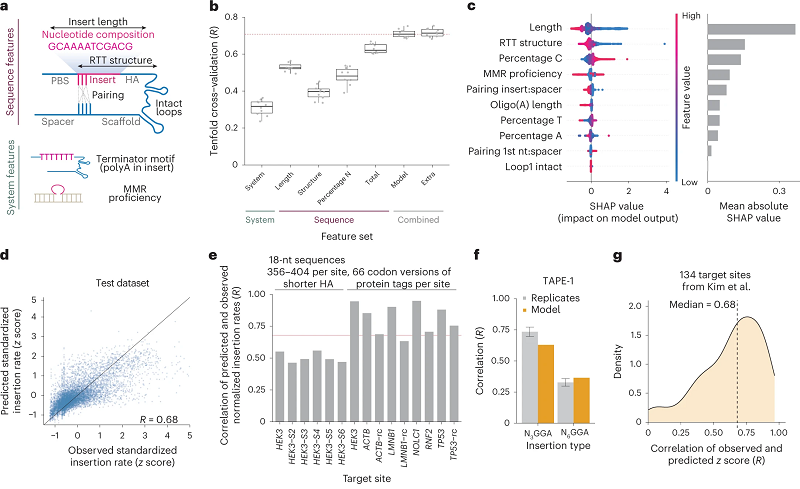
图2 预测prime插入效率
最后,对于如何提高prime editing系统的插入效率,研究人员提出了几点建议。他们建议选择胞嘧啶含量高且容易形成二级结构的序列。对于使用U6启动子的pegRNA,尽量避免腺嘌呤的插入。对于小于14nt的序列,暂时抑制MMR或敲除MLH1将极大提高插入效率。总的来说,这项工作增加了人们对短序列插入效率的理解,有望实现复杂的基因组工程和纠正各种致病突变。
本文转载自“小桔灯网”