在疾病流行的背景下,临床医生和研究人员获得世界各地不同团队正在建立的快速和高质量的临床试验信息是至关重要的,这些结果将告知使用的抗病毒药物、其剂量和持续时间、患者的纳入和排除标准、将要评估的结果以及临床试验的设计。巴黎大学于3月20日在medRxiv上发表了一篇综述文章,总结分析了COVID-19治疗研究的概况,并回顾了相关的注册临床研究试验。

https://doi.org/10.1101/2020.03.18.20038190
文章中,研究人员回顾了包括中国(www.chictr.org.cn/)、美国(https://clinicaltrials.gov/)、韩国(https://cris.nih.go.kr/cris/en/)、伊朗(https://www.irct.ir/)、日本(https://rctportal.niph.go.jp/en/)和欧洲(https://www.clinicaltrialsregister.eu/)等地的注册机构数据库截至2020年3月7日的相关注册临床试验,检索词为“2019-nCoV”、“COVID-19”、“SARS-CoV-2”、“Hcov-19”、“new coronavirus”、“novel coronavirus”。
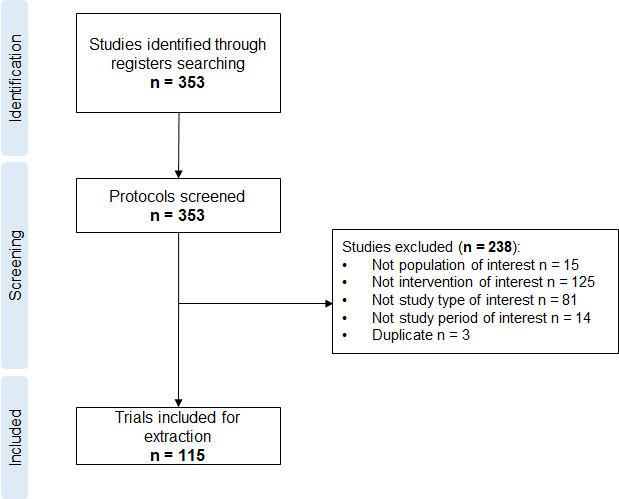
临床试验的选择过程
在确定的353项研究中,研究人员选择了115项临床试验进行数据提取,其中IV期试验是最常报告的研究类型(n=27,23%),然而有62个试验(54%)没有描述研究的阶段。80%的试验(n=92)采用平行随机组,计划纳入的研究对象中位数为63(IQR,36-120);开放性研究是最常见的(46%),其次是双盲研究(13%)和单盲研究(10%)。
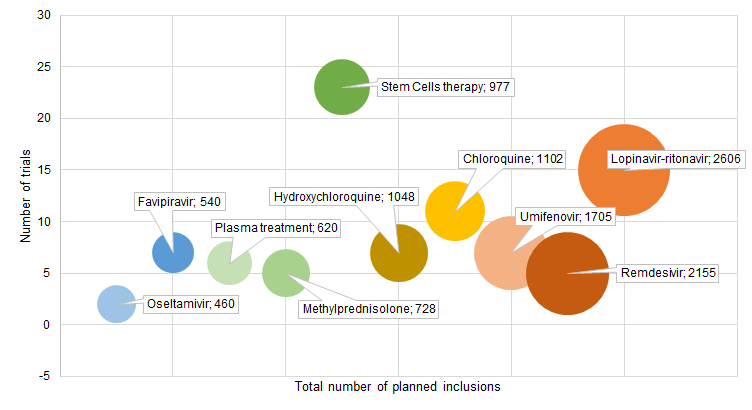
十种最常被评估的治疗方案计划纳入总数的试验数量
(圆圈的大小对应于所有评估一种治疗方案试验的计划纳入总数的和)
评估疗法最常用的是:干细胞疗法(n=23)、洛匹那韦/利托那韦(n=15)、氯喹(n=11)、阿比朵尔(n=9)、羟氯喹(n=7)、血浆治疗(n=7)、法匹拉韦(n=7)、甲基泼尼松龙(n=5)和瑞德西韦(n=5)。瑞德西韦在5个试验中进行了测试,每个试验计划纳入的研究对象的中位数为400(IQR,394-453),而干细胞治疗在23个试验中进行了测试,但每个试验计划纳入的研究对象的中位数为40(IQR,23-60);洛匹那韦/利托那韦有关试验计划纳入的研究对象的总数最高(2606),其次是瑞姆西韦(2155)。
在115项临床试验中,只有52%报告了治疗剂量(n=60),34% (n=39)报告了持续时间;从主要结果来看,临床研究76项(66%)、病毒学研究27项(23%)、放射学研究9项(8%)、免疫学研究3项(3%)。
这篇文章强调了在疾病暴发期间尽可能详细地注册临床试验的必要性,以便为未来试验的发展提供信息。报告尽可能多的细节是进行一致的临床试验并提高结果可重复性的关键,特别是因为研究通常与计划的内含物数量少、结果复杂或结果差有关,从而限制了治疗效果的评估。
参考资料:
1.A brief review of antiviral drugs evaluated in registered clinical trials for COVID-19