本文转载自“NEJM医学前沿”,作者曹彬等。原标题“NEJM官方翻译|中国团队洛匹那韦-利托那韦治疗重症COVID-19。”
北京时间3月19日,《新英格兰医学杂志》(NEJM)在线发表中国团队关于使用洛匹那韦/利托那韦治疗重症新冠病毒病(COVID-19)的临床试验结果。这是新冠病毒疫情暴发以来,世界顶级医学杂志首次发表治疗COVID-19的临床试验结果,也是在包括SARS在内的近20年新发传染病疫情期间发表的屈指可数的药物临床试验结果。同期配发的NEJM社论称赞该临床试验为英勇之举。
论文主要作者来自中日友好医院、国家呼吸病临床研究中心以及武汉金银潭医院。
在此,我们发表论文的全文翻译。今天《NEJM医学前沿》微信公众号的头条文章发表了论文主要作者撰写的述评,亦请您关注我们的官网(nejmqianyan.cn)和APP。
洛匹那韦-利托那韦治疗重症COVID-19成人住院患者的试验
A Trial of Lopinavir–Ritonavir in Adults Hospitalized with Severe Covid-19
DOI: 10.1056/NEJMoa2001282
摘 要
背景
目前尚无任何经证实可有效治疗SARS-CoV-2所致重症疾病的方法。
方法
我们在确诊SARS-CoV-2感染(患呼吸系统疾病COVID-19)并且呼吸周围空气时氧饱和度(SaO2)≤94%或者氧分压(PaO2)与吸入氧浓度(FiO2)的比值<300 mmHg的成人住院患者中开展了一项随机、对照、开放标签的试验。我们以1:1的比例将患者随机分组,分别接受常规治疗联合14日的每日两次洛匹那韦-利托那韦(分别为400 mg和100 mg)治疗或者单独常规治疗。主要终点是至临床状况改善的时间,其定义为从随机分组至7分等级量表评分改善2分或者出院(以先发生的一项为准)的时间。
结果
共计199例实验室确诊SARS-CoV-2感染的患者被随机分组;99例被分配至洛匹那韦-利托那韦组,100例被分配至常规治疗组。在至临床状况改善的时间方面,洛匹那韦-利托那韦治疗与常规治疗无差异(临床改善的风险比,1.24;95%置信区间[CI],0.90~1.72)。洛匹那韦-利托那韦组和常规治疗组的28日死亡率相似(19.2%vs. 25.0%;差异,-5.8个百分点;95% CI,-17.3~5.7)。两组在各时间点可检出病毒RNA的患者百分比相似。在改良意向治疗分析中,与常规治疗相比,洛匹那韦-利托那韦治疗使至临床状况改善的中位时间提前了1天(风险比,1.39;95% CI,1.00~1.91)。洛匹那韦-利托那韦组的胃肠道不良事件发生率较高,但常规治疗组的严重不良事件发生率较高。13例患者(13.8%)因不良事件提前停止洛匹那韦-利托那韦治疗。
结论
在重症COVID-19成人住院患者中,与常规治疗相比,我们未观察到洛匹那韦-利托那韦治疗有益。未来对重症患者开展的试验可能有助于确认或排除该方案产生益处的可能性。(由中国国家重大新药创制科技重大专项等资助;中国临床试验注册号为ChiCTR2000029308。)
从2019年12月开始,一种名为SARS-CoV-2的新型冠状病毒在全球引发了称为COVID-19的呼吸系统疾病的暴发。COVID-19的完整疾病谱范围是从轻度自限性呼吸道疾病到重度进行性肺炎、多器官衰竭和死亡。迄今为止尚无针对冠状病毒感染的特异性治疗药物。
2003年严重急性呼吸系统综合征(SARS)出现后,对已获批准的药物进行筛选后发现,洛匹那韦(人类免疫缺陷病毒[HIV]1型的天冬氨酸蛋白酶抑制剂)对引起人类SARS的SARS-CoV病毒具有体外抑制活性。
利托那韦与洛匹那韦联用可通过抑制细胞色素P450来延长洛匹那韦的血浆半衰期。2004年发表的一项开放标签研究提示,与仅接受利巴韦林治疗的历史对照组相比,利巴韦林加用洛匹那韦-利托那韦(分别为400 mg和100 mg)降低了SARS患者的不良临床结局(急性呼吸窘迫综合征[ARDS]或死亡)风险和病毒载量。
然而,由于上述研究未进行随机化,无同期对照组,并且联用了糖皮质激素和利巴韦林,因此难以评估洛匹那韦-利托那韦的作用。类似地,在体外试验和动物模型中,洛匹那韦对中东呼吸系统综合征冠状病毒(MERS-CoV)均有活性,并且有病例报告指出洛匹那韦-利托那韦与利巴韦林和干扰素(IFN)α联用可清除病毒,使患者存活。然而,目前尚无确实数据证明将该疗法用于人体的疗效,因此治疗MERS的一项临床试验(联用重组干扰素β-1b)目前正在进行中(在ClinicalTrials.gov注册号为NCT02845843)。
为了评估口服洛匹那韦-利托那韦治疗SARS-CoV-2感染的疗效和安全性,我们在COVID-19成人住院患者中开展了一项随机、对照、开放标签试验LOTUS China(在中国开展的洛匹那韦抑制SARS-Cov-2试验[LopinavirTrial for suppression of SARS-Cov-2 in China])。
方法
患者
我们根据地方疾控中心(CDC)或指定诊断实验室检测出的呼吸道样本SARS-CoV-2逆转录-聚合酶链反应(RT-PCR)(上海之江生物科技股份有限公司或圣湘生物科技股份有限公司)阳性结果评估患者是否符合参与本试验的标准。
本试验的纳入标准如下:年龄≥18岁,诊断标本的RT-PCR结果呈阳性,胸部影像学检查确诊肺炎,呼吸周围空气时氧饱和度(SaO2)≤94%或氧分压(PaO2)与吸入氧浓度(FiO2)的比值(PaO2:FiO)≤300 mm Hg的男性和非妊娠期女性患者。
排除标准包括医师认为参与试验不符合患者的最佳利益,患者有导致其无法安全遵循试验方案的状况,已知对洛匹那韦-利托那韦过敏或超敏,已知患重度肝病(例如肝硬化,丙氨酸转氨酶水平>5倍正常范围上限或天冬氨酸转氨酶水平>5倍正常范围上限),正在服用与洛匹那韦-利托那韦有配伍禁忌并且在试验期间不能更换或停用的药物(参见补充附录,补充附录与本文原文可在NEJM.org获取),处于妊娠期或哺乳期或者已知有HIV感染(原因是担心在不联用其他抗逆转录病毒药的情况下,患者对洛匹那韦-利托那韦产生耐药性)。无法吞咽的患者通过鼻胃管接受了洛匹那韦-利托那韦给药。
试验设计和监管
这是一项于2020年1月18日至2020年2月3日(最后一例患者的入组日期)在中国湖北省武汉市金银潭医院开展的开放标签、个体患者随机对照试验。由于试验紧急,我们未能制备洛匹那韦-利托那韦的安慰剂。我们以1:1的比例将符合参与试验标准的患者随机分成两组,分别接受为期14日的常规治疗联合每日两次洛匹那韦-利托那韦(400 mg和100 mg,口服;由国家卫生机构免费提供)治疗或单独接受常规治疗。
根据患者的需要,常规治疗包括吸氧、无创和有创通气、抗生素、血管加压药、肾脏替代疗法和体外膜氧合(ECMO)。作为呼吸衰竭严重程度的指标,为了平衡两组之间氧气支持的分布情况,我们根据患者入组时的呼吸支持方法对随机分组进行了分层:无氧气支持或者采用鼻导管或面罩的氧气支持,或者高流量氧无创通气,或者包括ECMO在内的有创通气。置换区组(每个区组4例患者)随机序列(包括分层)是由一名未参与本试验的统计学家应用9.4版SAS软件(SAS Institute)准备。为了尽量减小分配偏倚,我们采用交互式网络应答系统对分组情况进行掩蔽,直至通过计算机或电话在该系统上完成随机分组。
本试验获得了金银潭医院机构审查委员会的批准。我们从所有患者,或者患者病情过重的情况下从其法定代表获得了书面知情同意。本试验按照《赫尔辛基宣言》和国际协调会议《药物临床试验质量管理规范》的原则实施。作者负责设计试验以及汇总和分析数据。作者保证数据的完整性和准确性,并保证试验对试验方案的依从性。关于试验设计的完整详细信息见试验方案,试验方案可在NEJM.org获取。
临床和实验室监测
在第0至至第28日、患者出院或患者死亡期间,由训练有素的护士每日两次根据日记卡评估患者状况,日记卡中记录了7分等级量表数据和安全性数据。安全性由金银潭医院的药物临床试验质量管理规范办公室监察。其他临床数据采用WHO-ISARIC(世界卫生组织-国际严重急性呼吸系统和新发感染联合会[International Severe Acute Respiratory and EmergingInfections Consortium])病例记录表进行记录(https://isaric.tghn.org)。
我们在第1日(服用洛匹那韦-利托那韦之前)及第5、10、14、21和28日(直至患者出院或死亡)采集了患者的口咽拭子样本,并在上海观合医药科技有限公司(泰格和迪安的合资公司)进行了实时定量RT-PCR检测(参见补充附录)。我们应用MagNA Pure 96系统从临床样本中提取RNA,并应用LightMix Modular SARS CoV检测法(TIB MOBIOL),通过Cobas z480 qPCR(罗氏)检测和定量RNA。
我们在每个时间点均从199例患者中的所有仍存活患者采集了这些样本。并未因某一时间点的拭子检测结果呈阴性而停止之后的样本采集。对基线咽拭子进行了E基因、RdRp基因和N基因检测,对之后的样本进行了E基因定量和定性检测。临床数据记录在纸质病例记录表中,之后由试验人员两次重复输入电子数据库并进行确认。
结局指标
主要终点是至临床状况改善的时间,其定义为从随机分组至7分等级量表改善2分(与随机分组时的状况相比)或至出院的时间,以先发生的一项为准。临床状况改善终点已在我们之前的流感研究中使用过,也是WHO研发蓝图(R&D Blueprint)专家组推荐的终点。等级量表在之前已被用作重症流感住院患者临床试验的终点。7分等级量表包括以下等级:1. 未住院,且可继续从事日常活动;2. 未住院,但无法继续从事日常活动;3. 住院治疗,不需要吸氧;4. 住院治疗,需要吸氧;5. 住院治疗,需要经鼻高流量氧疗、无创机械通气或这两者;6. 住院治疗,需要ECMO、有创机械通气或这两者均需要;7. 死亡。
其他临床结局包括在第7日和第14日时采用7分等级量表评估的临床状况、28日死亡率、机械通气持续时间、生存者的住院时长以及从治疗开始至死亡的时间(天数)。病毒学指标包括随时间推移,检出病毒RNA的患者比例以及病毒RNA滴度曲线下面积(AUC)测定值。
安全性结局包括治疗期间发生的不良事件、严重不良事件和提前停止治疗。不良事件根据美国国立癌症研究所《不良事件通用术语标准》(National Cancer Institute Common Terminology Criteria forAdverse Events)4.0版进行分级。
统计学分析
启动本试验是对COVID-19突发公共卫生事件做出的迅速应对,当时关于COVID-19住院患者临床结局的信息非常有限。最初设定的总样本量为160例患者,原因是假设常规治疗组至临床状况改善的中位时间为20天,并且有75%的患者将达到临床状况改善,则160例患者的样本量将使本试验以80%的统计学功效在α=0.05的双侧显著性水平检测出两组的中位时间有8天的差异。按照原计划进行的160例患者的入组工作很快完成,但当时判定本试验的统计学功效不足;因此决定由研究者继续纳入患者。之后,在另一种药物(瑞德西韦,remdesivir)可用于临床试验之后,我们决定暂停本试验的患者入组工作。
主要疗效分析是在意向治疗的基础上进行,包括接受了随机分组的所有患者。我们在所有患者达到第28日之后评估了至临床状况改善的时间,并将第28日之前未达到临床状况改善或死亡的患者在第28日右删失(如果一个人在接受观察的最后时间之后可能发生了事件,但发生事件的具体时间未知,则进行右删失)。
通过Kaplan–Meier曲线绘制至临床状况改善的时间,并通过时序检验方法进行比较。通过Cox比例风险模型计算风险比和95%置信区间。有5例被分配到洛匹那韦-利托那韦组的患者并未接受洛匹那韦-利托那韦治疗(其中3人在24小时内死亡),但被纳入了意向治疗分析,因为常规治疗组中并无相应的患者被排除的情况。我们还进行了一项排除3例早期死亡患者的改良意向治疗分析。事后分析包括对英国国家早期预警评分2(National Early Warning Score 2,NEWS2)≤5分或>5分进行的亚组分析,以及对发病后≤12天或>12天接受随机分组的患者进行的亚组分析。
因为统计学分析计划未规定对次要结局或其他结局检验进行多重性校正,因此我们将结果报告为点估计值和95%置信区间。置信区间宽度未进行多重性校正,因此不能将置信区间用于推断对于次要结局的明确疗效。安全性分析是基于患者实际接受的治疗。我们采用9.4版SAS软件进行了统计学分析(SAS Institute)。
结果
患者
在被随机分组的199例患者中,99例患者被分配接受洛匹那韦-利托那韦治疗,100例患者被分配接受单独常规治疗。在被分配到洛匹那韦-利托那韦组的99例患者中,94例(94.9%)接受了分配的治疗(图1)。在洛匹那韦-利托那韦组中,5例患者未接受洛匹那韦-利托那韦治疗,其中3例的原因是在随机分组后24小时内早期死亡,另外2例的原因是随机分组后,主治医师拒绝开出洛匹那韦-利托那韦。
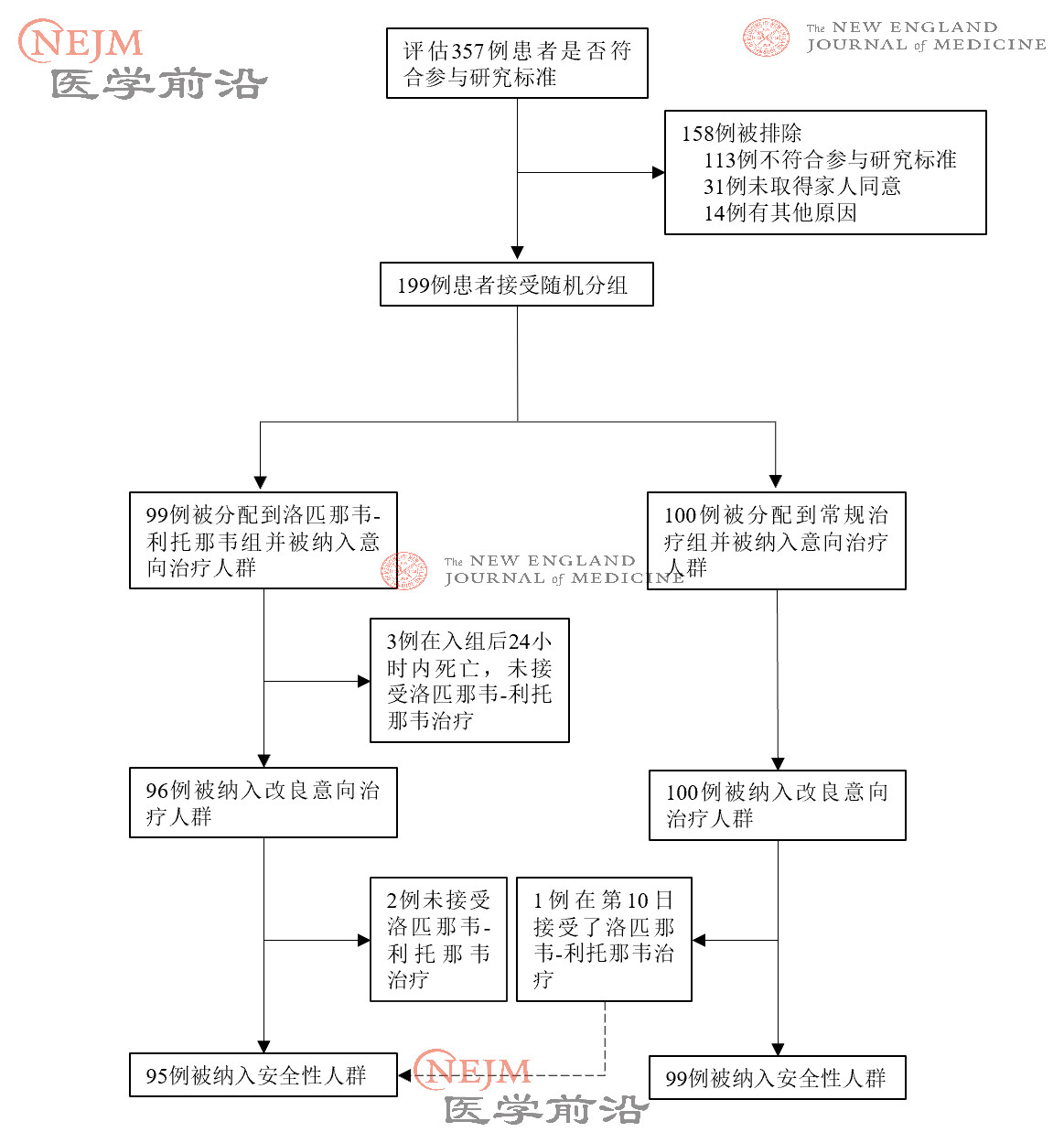
图1. 随机化和治疗分配。
患者中位年龄为58岁(四分位距[IQR],49~68岁),60.3%的患者为男性(表1)。出现症状和随机分组的中位间隔时间为13天(IQR,11~16天)(表2)。在人口统计学特征、基线实验室检查结果、等级量表评分分布情况或入组时的NEWS2评分方面,两组间无重要差异。在本试验期间,洛匹那韦-利托那韦组33.0%的患者和常规治疗组35.7%的患者接受了全身糖皮质激素治疗。
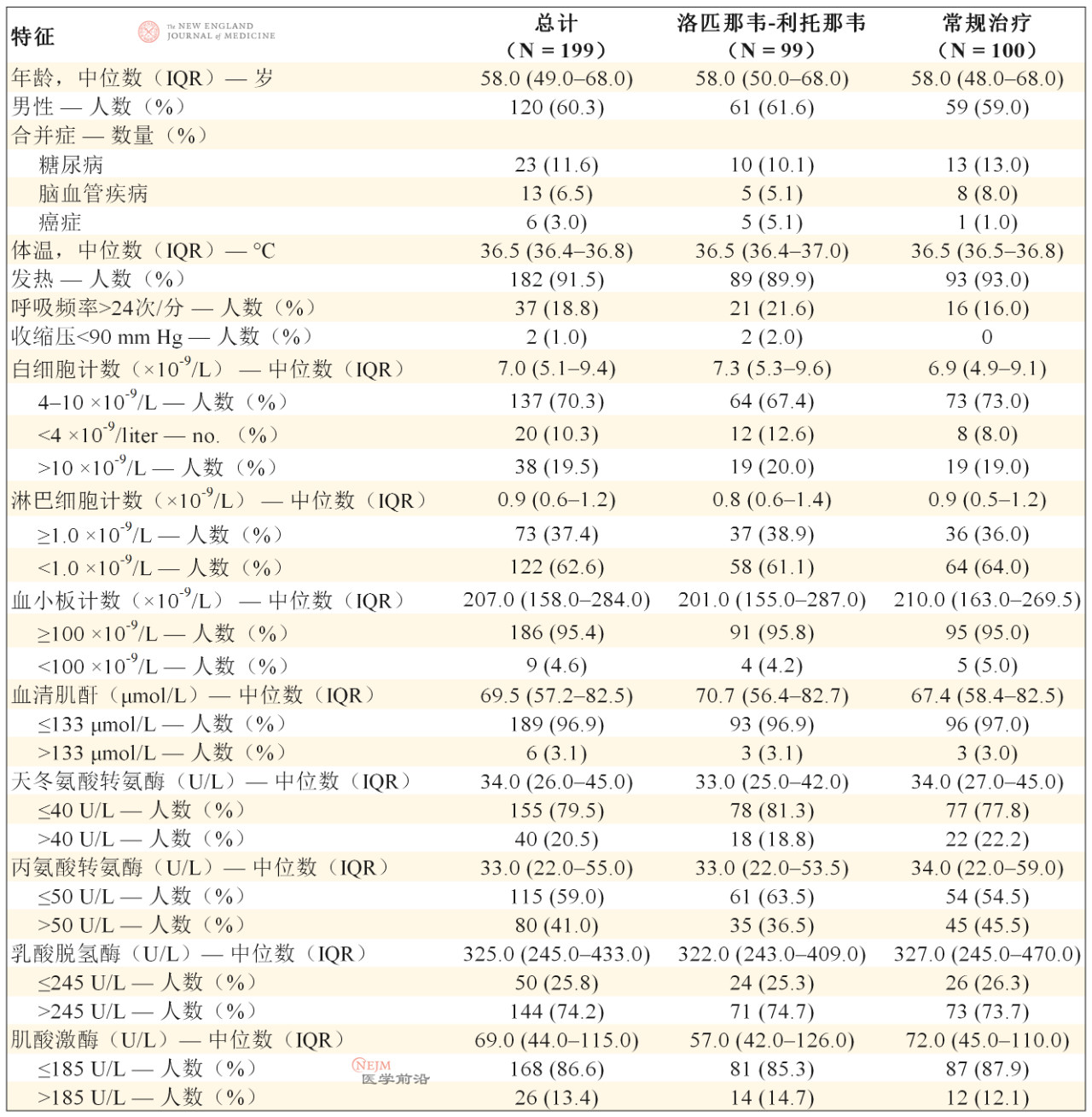
表1. 患者基线人口统计学和临床特征。*
* 表中列出的数值是基于获得的数据。我们获得了洛匹那韦-利托那韦组95例患者的白细胞计数、淋巴细胞计数、血小板计数、乳酸脱氢酶和肌酸激酶的实验室检查值;获得了该组96例患者的血清肌酐、天冬氨酸转氨酶和丙氨酸转氨酶的数值。我们获得了常规治疗组99例患者的血清肌酐、天冬氨酸转氨酶、丙氨酸转氨酶、乳酸脱氢酶和肌酸激酶的实验室检查值。将肌酐值转换为mg/dL需除以88.4。IQR表示四分位距。
表2. 患者纳入试验时或纳入试验后的状态和接受的治疗。*
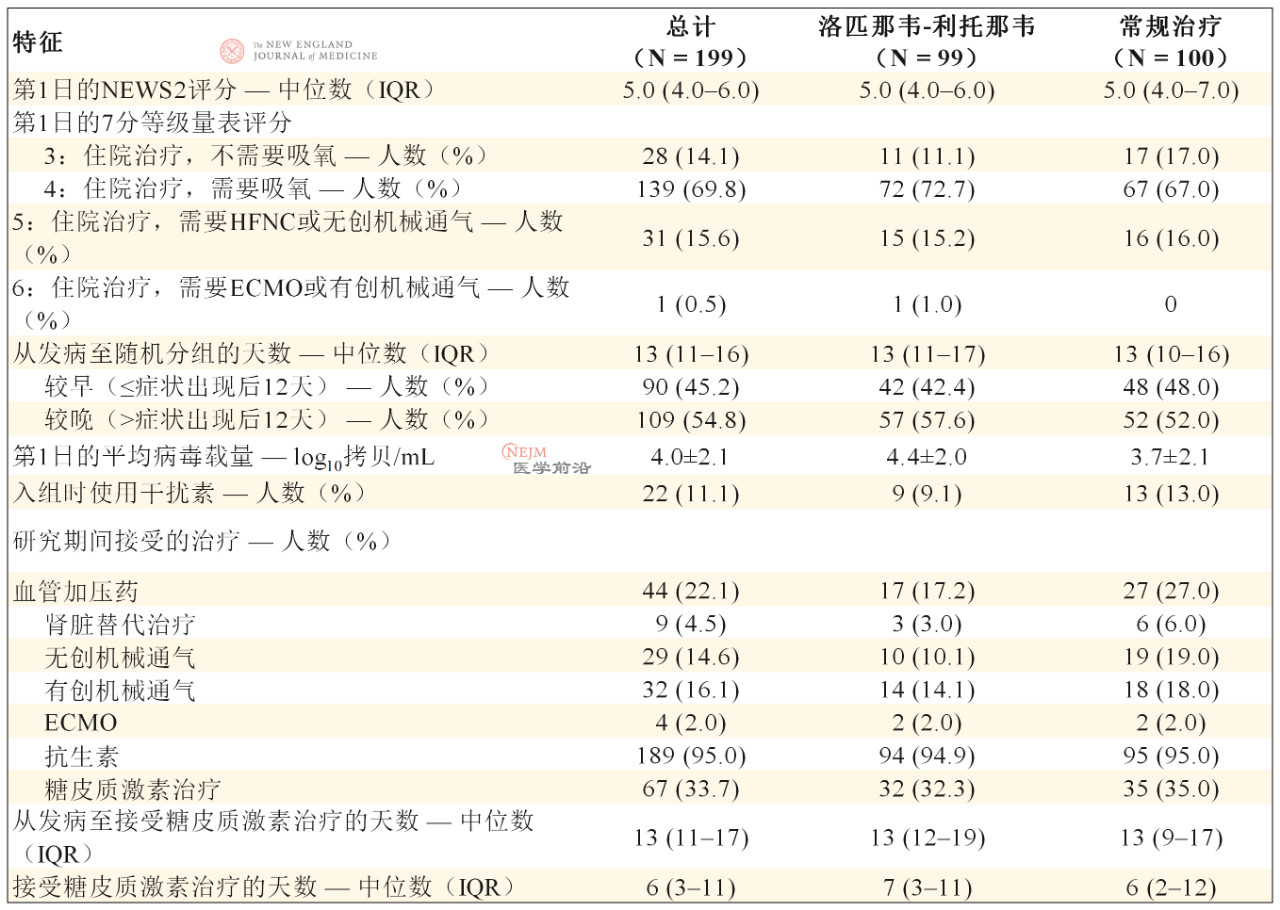
* 加减值为均值±SD。ECMO表示体外膜氧合,HFNC表示经鼻高流量氧疗,NEWS2表示英国国家早期预警评分2。
主要结局
在意向治疗人群中,洛匹那韦-利托那韦组和常规治疗组患者至临床状况改善的时间无差异(中位数,16天vs. 16天;临床改善的风险比,1.31;95%置信区间[CI],0.95~1.85;P=0.09)(图2)。在改良意向治疗人群中,洛匹那韦-利托那韦组和常规治疗组患者至临床状况改善的中位时间分别为15天和16天(风险比,1.39;95% CI,1.00~1.91)(补充附录表S1和图S1)。在意向治疗人群中,症状出现后12日内接受洛匹那韦-利托那韦治疗与较早达到临床状况改善相关(风险比,1.25;95% CI,1.77~2.05),而较晚接受洛匹那韦-利托那韦治疗则与较早达到临床状况改善不相关(风险比,1.30;95% CI,0.84~1.99)(图S2A和S2B)。在意向治疗人群中,如果根据入组时的NEWS2评分对至临床状况改善的时间进行评估,未观察到显著差异(图S3A和S3B)。此外,两组之间至临床状况恶化(定义为7分量表评分加重1分)的时间无差异(临床改善的风险比,1.01;95% CI,0.76~1.34)(图S4)。
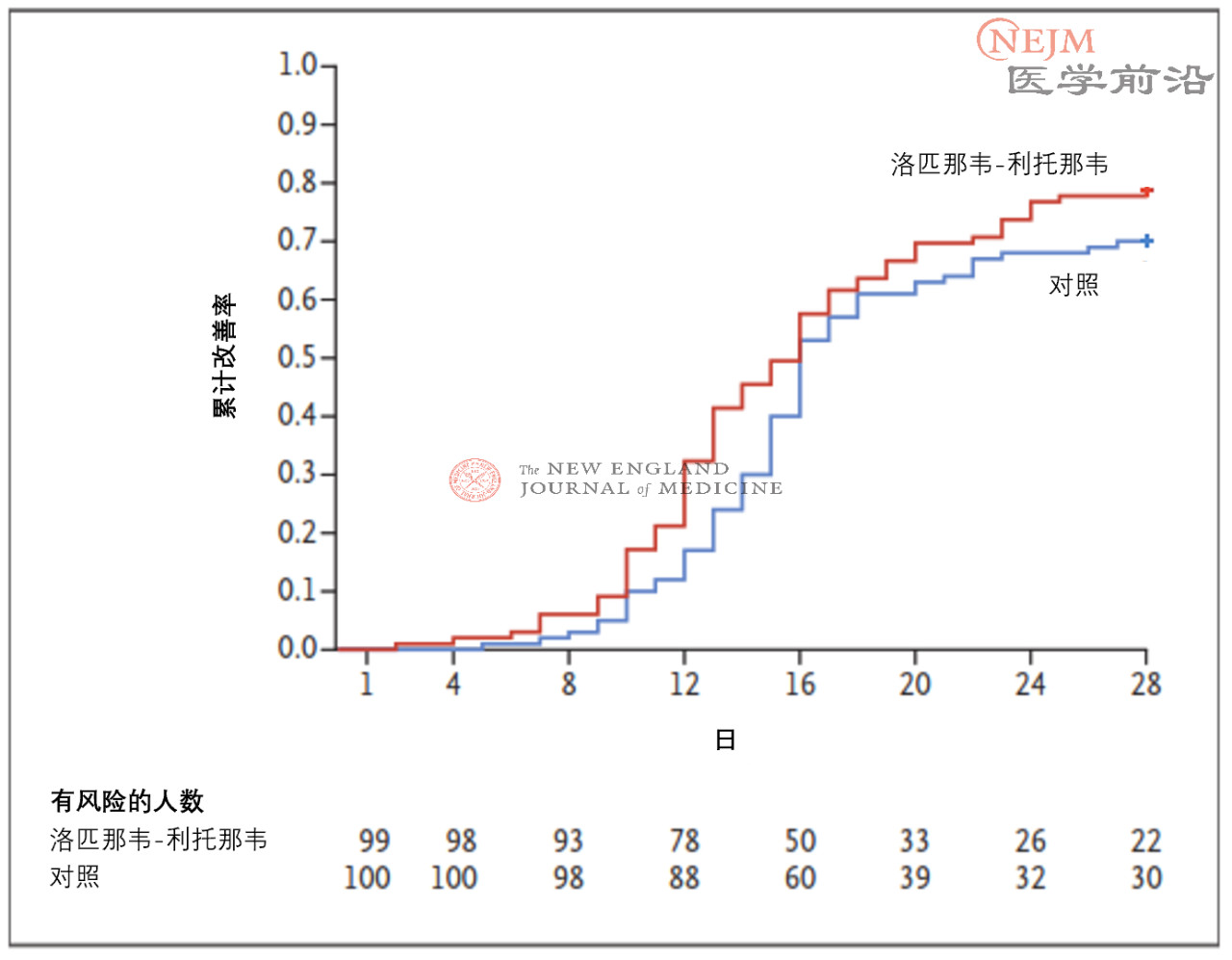
图2. 意向治疗人群中至临床状况改善的时间。
次要结局
在意向治疗人群(19.2% vs. 25.0%;差异,-5.8个百分点;95% CI,-17.3~5.7)或改良意向治疗人群(16.7% vs. 25.0%;差异,-8.3个百分点;95% CI,-19.6~3)中,洛匹那韦-利托那韦组的28日死亡率在数值上均低于常规治疗组(表3)。
洛匹那韦-利托那韦组患者的重症监护病房(ICU)住院时间比常规治疗组患者短(中位数,6天vs. 11天;差异,-5天;95% CI,-9~0),并且从随机分组至出院的时间在数值上比常规治疗组短(中位数,12天vs. 14天;差异,1天;95% CI,0~3)。此外,第14日时,洛匹那韦-利托那韦组中临床状况改善的患者百分比高于常规治疗组(45.5% vs. 30.0%;差异,15.5个百分点;95% CI,2.2~28.8)(图S5)。其他结局(例如吸氧持续时间、住院时长和从随机分组至死亡的时间)无显著差异。
表3. 意向治疗人群的结局。*
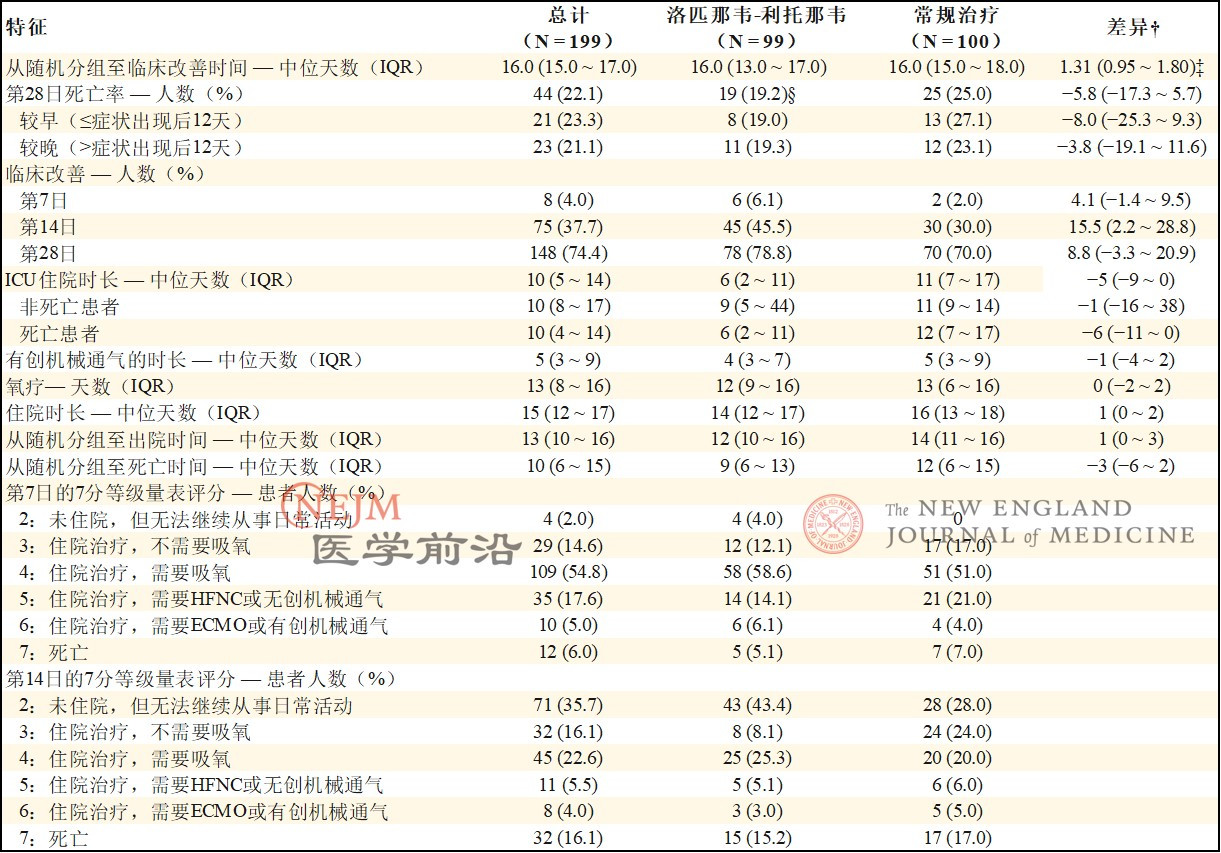
* 临床状况改善的定义为在修订版7分等级量表上,临床状况下降2分或者出院。ICU表示重症监护病房。
† 差异表示为率差或者中位差(Hodges–Lehmann估计)和95%置信区间。
‡ 利用Cox比例风险模型估算临床改善的风险比。
§ 这一总数包括在随机分组后24小时内死亡,因此未接受洛匹那韦-利托那韦治疗的3例患者。
病毒学
在诊断性呼吸道样本的RT-PCR检测结果呈阳性的患者中,共计69例(35%)患者的咽拭子样本(获取知情同意后采集的样本)RT-PCR检测结果呈阴性。随机分组时,洛匹那韦-利托那韦组患者咽拭子样本(获取知情同意后采集的样本)的基线病毒RNA载量平均值(±SD)略高于常规治疗组(4.4±2.0 log10 拷贝/mL vs. 3.7±2.1 log10拷贝/mL)(表2)。洛匹那韦-利托那韦组患者和常规治疗组患者随时间推移的病毒RNA载量无差异(图3),包括根据患病时间进行的分析(图S6)。
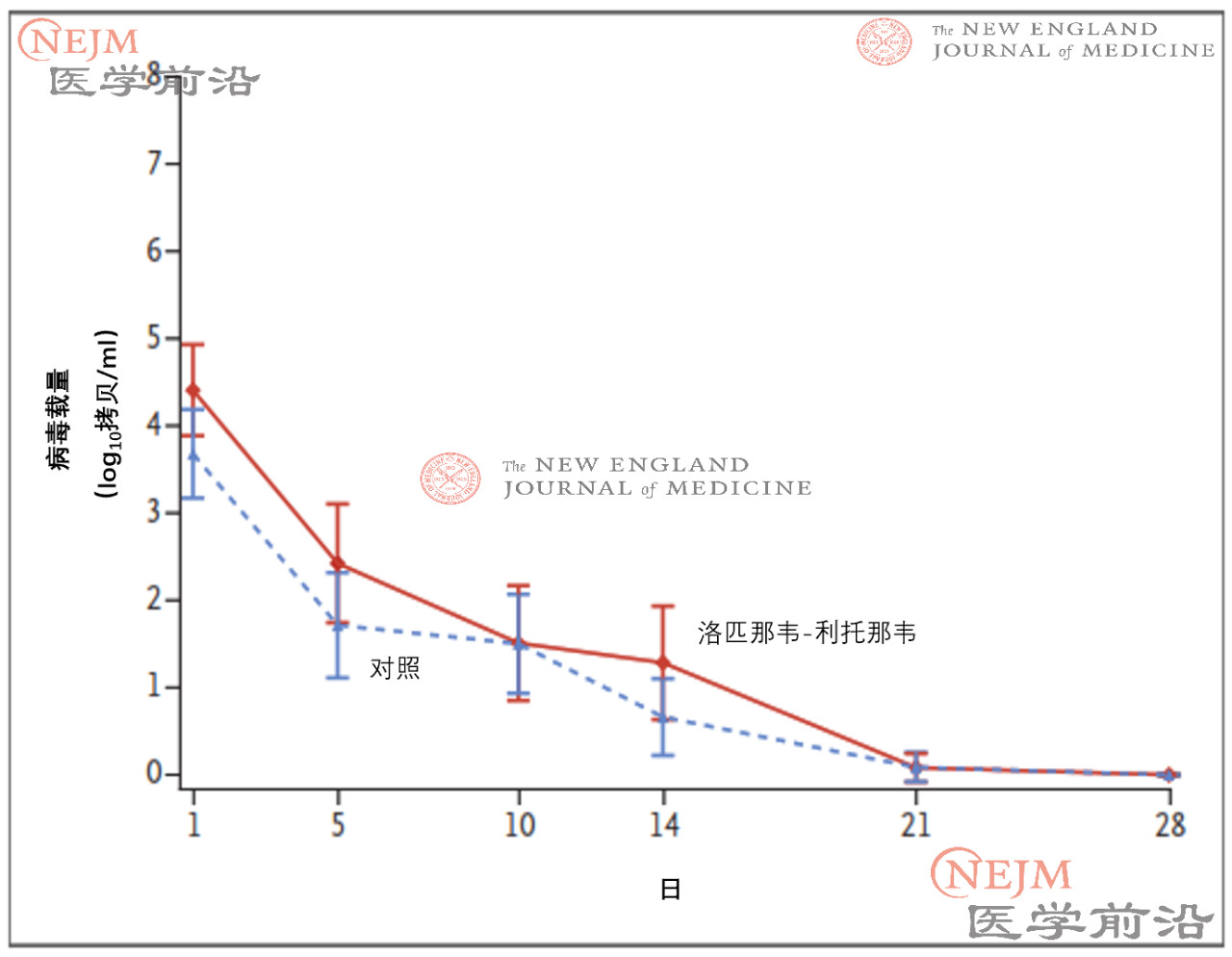
图3. 通过qPCR测出的咽拭子标本SARS-CoV-2病毒RNA载量相对于基线的平均变化。
I条表示95%置信区间。小于聚合酶链反应(PCR)检测定量下限并且大于定性检测限的结果用1 log10 拷贝/ml填补;病毒RNA阴性的患者结果用0 log10拷贝/mL填补。在199例患者中,130例(洛匹那韦-利托那韦组59例和常规治疗组71例)有用于计算病毒载量的病毒学数据,而其余患者在此期间的咽拭子未检出病毒RNA。
在任何采样日,洛匹那韦-利托那韦组和常规治疗组可检出SARS-CoV-2病毒RNA的患者百分比均相似(第5日,34.5% vs. 32.9%;第10日,50.0% vs. 48.6%;第14日,55.2% vs. 57.1%;第21日,58.6% vs. 58.6%;第28日,60.3% vs. 58.6%)(表S2)。
安全性
洛匹那韦-利托那韦组46例患者(48.4%)和常规治疗组49例患者(49.5%)在随机分组至第28日期间报告了不良事件(表4)。洛匹那韦-利托那韦组中胃肠道不良事件(包括恶心、呕吐和腹泻)的发生率高于常规治疗组(表4)。两组中有实验室检查结果异常的患者百分比相似(表4)。51例患者发生了严重不良事件:洛匹那韦-利托那韦组19起和常规治疗组32起(表4)。洛匹那韦-利托那韦组发生了4起胃肠道严重不良事件,而常规治疗组未发生胃肠道严重不良事件;研究者判定这4起事件均与试验药物相关。常规治疗组患者的呼吸衰竭、急性肾损伤和继发感染发生率高于洛匹那韦-利托那韦组。研究中心的研究者判定观察期间的所有死亡均与干预无关。
表4. 安全性人群中的不良事件总结。*
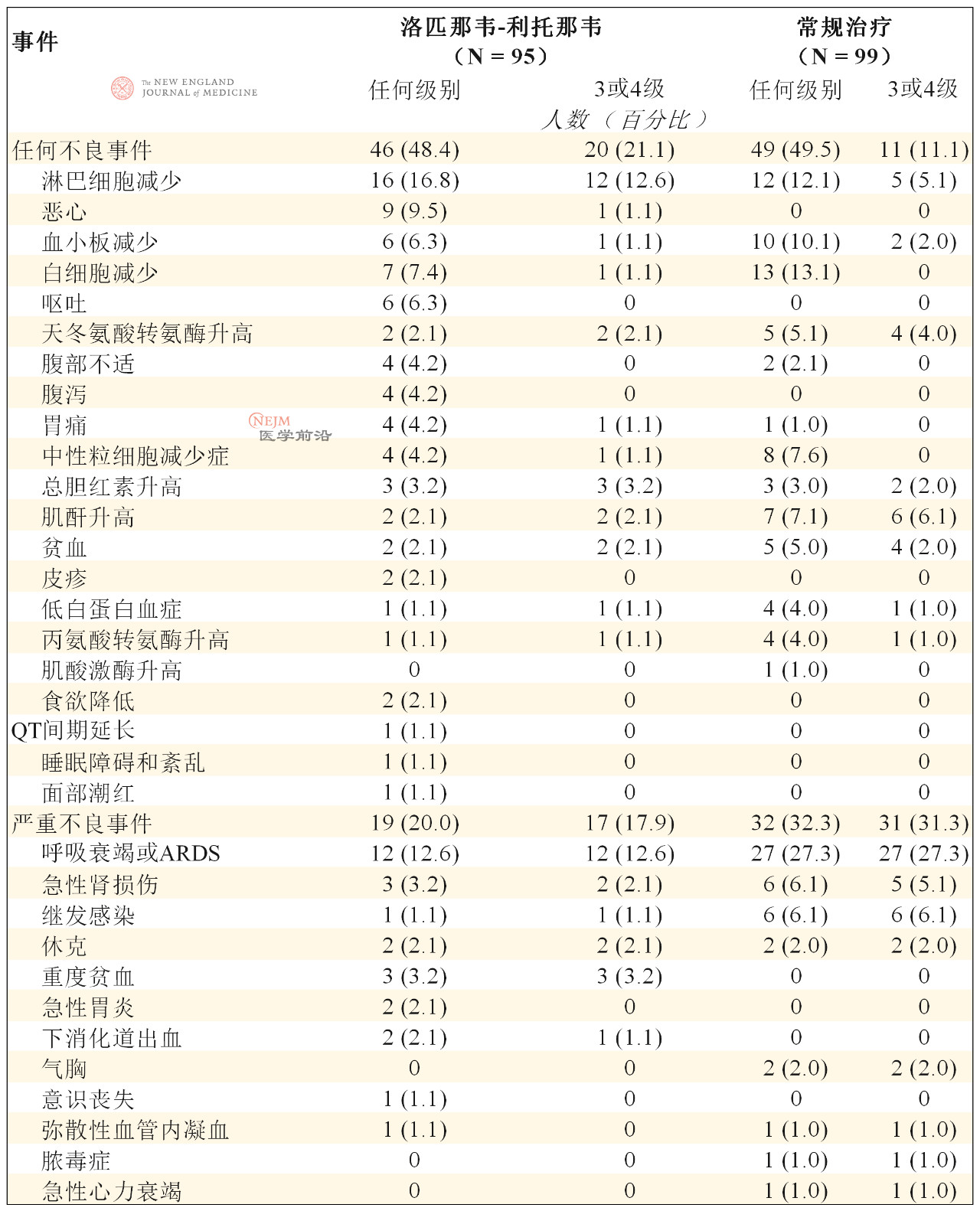
* 表中列出了随机分组后至第28日期间,发生于1例以上患者的不良事件。一些患者有多起不良事件。由于并无适用于高敏肌钙蛋白(心脏生物标志物)血清水平和血脂水平的不良事件分级标准,因此表中列出了数值与基线相比发生恶化的患者比例。常规治疗组中高敏肌钙蛋白升高的患者比例高于洛匹那韦-利托那韦组(14.1% vs. 9.5%)。常规治疗组55例患者(52.4%)和洛匹那韦-利托那韦组65例患者(68.4%)的血脂水平在纳入试验时正常,但纳入试验后异常。所有死亡均由呼吸衰竭引起。ARDS表示急性呼吸窘迫综合征。
讨论
此项随机试验发现,对于COVID-19重症患者,与单独采用常规支持治疗相比,在常规治疗的基础上加用洛匹那韦-利托那韦并未出现临床状况改善或死亡率降低。然而,在排除了3例早期死亡患者的改良意向治疗分析中,两组间至临床状况改善的中位时间(中位数,15天 vs. 16天)尽管差异很小但达到了统计学显著性。值得注意的是,本试验的总死亡率(22.1%)明显高于COVID-19住院患者初始描述性研究中报告的11%~14.5%的死亡率,这表明我们纳入的是重症患者人群。
本试验的患者人群在入组时的患病时间和疾病严重程度方面具有异质性;事后分析发现,在症状出现后12日内接受治疗的亚组中,临床状况迅速康复(16.0日 vs. 17.0日)且死亡率较低(19.0% vs. 对27.1%),而症状出现后12日之后接受治疗的亚组则没有这一情况(图S2A和S2B)。对COVID-19早期采取洛匹那韦-利托那韦治疗是否具有临床益处是一个需要进一步研究的重要问题。这一观察结果与有研究表明SARS-CoV-2病毒性肺炎在发病第2周发生进展一致,也与之前在SARS和严重流感的抗病毒研究中观察到的起效时间一致。
此外,我们发现在接受洛匹那韦-利托那韦治疗的患者中,发生严重并发症(急性肾损伤和继发感染)或因呼吸衰竭而需要无创或有创机械通气的人数少于未接受治疗的患者。我们可根据这些观察结果提出假设,且需要通过进一步研究来确定在疾病某一阶段用药的洛匹那韦-利托那韦可否减少COVID-19的某些并发症。
与单独采用常规支持治疗相比,我们并未发现加用洛匹那韦-利托那韦可降低病毒RNA载量或缩短检出病毒RNA的时间。试验结束时(第28天),洛匹那韦-利托那韦组有40.7%的患者仍可检出SARS-CoV-2 RNA。近期一份报告指出,COVID-19重症患者排出病毒的中位持续时间是20天,最长可达37天24。上述研究和本研究中均无证据表明洛匹那韦-利托那韦具有显著抗病毒作用。药物看似未显示抗病毒作用的原因尚未明确,但本试验的采样方法很可能欠佳。
本试验只是间断性采样(在第1、5、10、14、21和28日采样),在前5日提高采样频率有可能更详细地体现出两组在这一关键时期的病毒载量动力学特征。此外,之前的研究表明,口咽拭子样本的病毒载量低于鼻咽拭子样本,而且重要的是,我们无法对下呼吸道分泌物进行采样。值得注意的是,根据所用的细胞类型不同,洛匹那韦对于SARS-CoV的体外半数有效浓度(EC50)范围为4.0~10.7 μg/mL,但也有其他研究报告洛匹那韦无效或需要更高浓度(25 μg/mL)才能产生抑制作用。对于MERS-CoV,EC50值范围为5~7 μg/mL。成人服用洛匹那韦后的平均峰值(9.6 μg/mL)和谷值(5.5 μg/mL)血清浓度都只是接近上述浓度。EC50值是否是合适的阈值,以及人体血浆内的非结合态洛匹那韦浓度是否足以抑制SARS-CoV-2仍有疑问。
接受洛匹那韦-利托那韦治疗的患者中有近14%无法完成14天的完整疗程。主要原因是厌食、恶心、腹部不适或腹泻等胃肠道不良事件和两起严重不良事件(均为急性胃炎)。有2例接受洛匹那韦-利托那韦的患者发生了自限性皮疹。肝损伤、胰腺炎、更严重的皮疹和QT延长风险等副作用以及因CYP3A抑制而发生多种药物相互作用的可能性在上述联合用药中均有充分记录。本试验中观察到的副作用令人担忧以改善患者结局为目的而提高洛匹那韦-利托那韦剂量或延长用药时间的做法。
本试验有几项局限性。其中尤其重要的是本试验未采用盲法,因此知晓分组情况可能影响了临床决策,进而可能影响了我们采用的7分等级量表。我们将继续随访这些患者,评估其远期预后。两组患者的基线特征基本平衡,但洛匹那韦-利托那韦组的咽喉部病毒载量略高,因此该组的病毒复制可能较多。
虽然我们在两组间并未观察到并用的其他药物(例如糖皮质激素)的用药率有差异,但这可能是另外一个混杂因素。此外,在洛匹那韦-利托那韦组中,第14日和第28日时分别有约45%和40%患者的口咽拭子RNA检测结果呈阳性,但我们并不知晓是否仍有具有传染性的病毒,因为我们并未尝试分离病毒,也未评估是否可能出现了对洛匹那韦易感性降低的SARS-CoV-2变异株。最后,我们并无这些重症患者(其中许多为危重患者)的洛匹那韦暴露水平数据。
总之,我们发现在COVID-19重症患者中,洛匹那韦-利托那韦未能显著加速临床状况的改善,未能降低死亡率,也未能减少咽喉部检出的病毒RNA。这些早期数据将为未来开展研究评估该方案和其他药物对SARS-CoV-2感染的疗效提供指导。SARS治疗中曾将洛匹那韦-利托那韦与其他抗病毒药联用,目前也正在MERS-CoV中研究联合用药,而在COVID-19治疗中将洛匹那韦-利托那韦与其他抗病毒药联用可否增强抗病毒效果,改善患者临床结局仍有待确定。
附件图表
表S1. 改良意向治疗人群的结局。
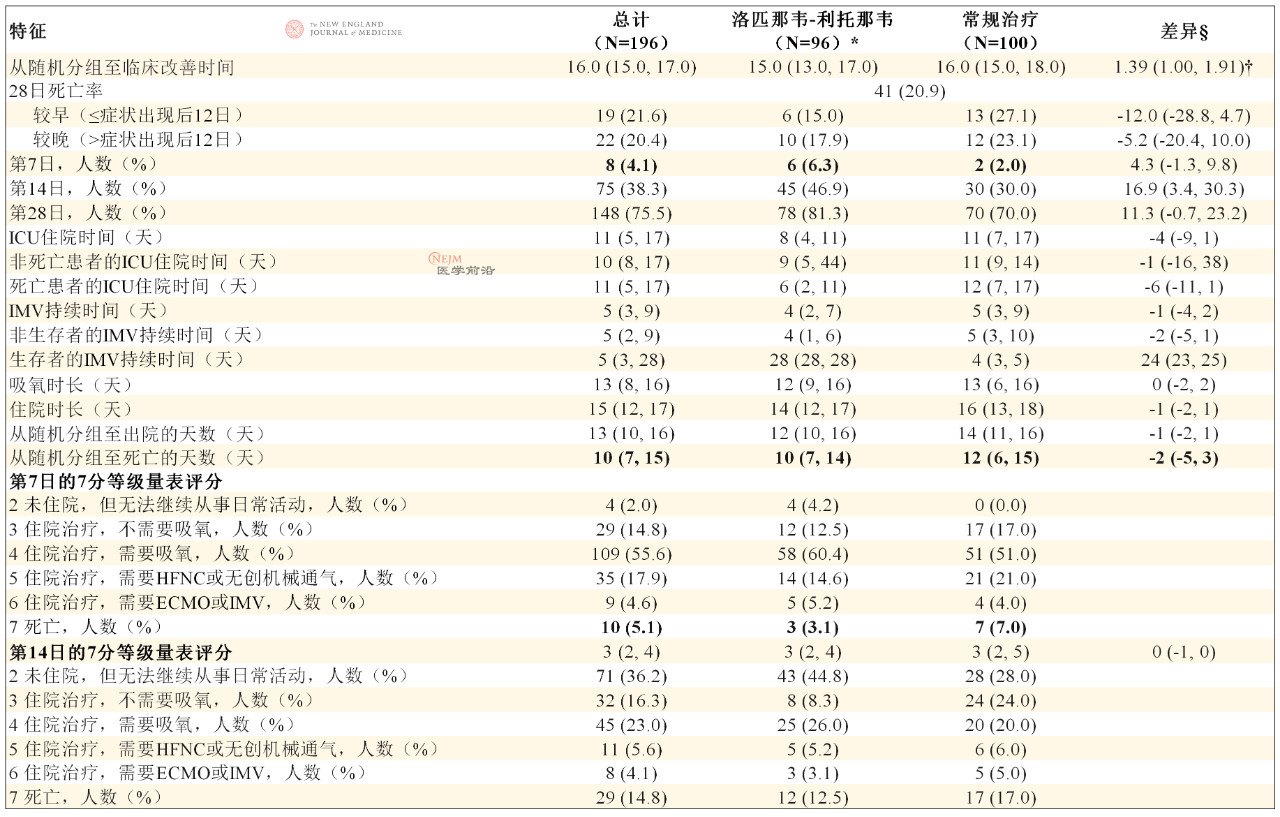
表中根据情况对人数(百分比)或中位数(四分位距)进行了总结。
缩写:ICU=重症监护病房;HFNC=经鼻高流量氧疗;IMV=有创机械通气;ECMO=体外膜氧合;TTCI=至临床状况改善的时间。
临床状况改善(事件)的定义为在修订版7分等级量表上,临床状况改善2分或者患者出院。
* 这一总数不包括在随机分组后24小时内死亡,因此未接受洛匹那韦/利托那韦治疗的3例患者。
§ 差异表示为率差或中位数差(Hodges-Lehmann估计)和置信区间。
† 利用Cox比例风险模型估算风险比。
表S2. 改良意向治疗人群的病毒学结局。

通过定量逆转录聚合酶链反应(qRT-PCR)分析法确定的mITT分析集(不包括未检出病毒RNA的患者)的AUC。小于PCR检测法定量下限并且大于定性检测限的结果用1 log10 拷贝/mL填补;病毒RNA阴性的患者结果用0 log10 拷贝/mL填补。AUC,曲线下面积。
§ 差异表示为率差或者Hodges-Lehmann估计值差异和95%置信区间。
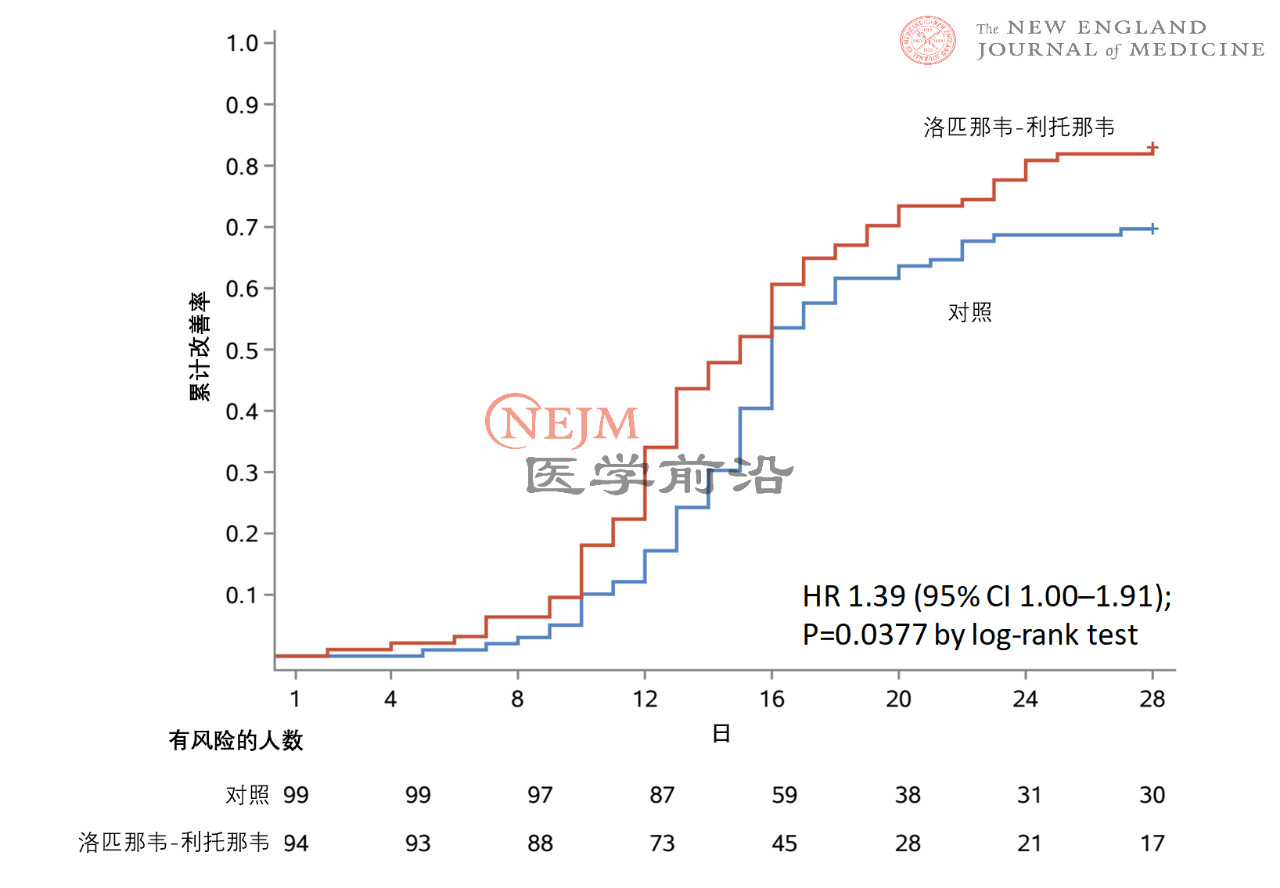
图S1. 改良意向治疗人群中至临床状况改善时间的Kaplan Meier曲线。
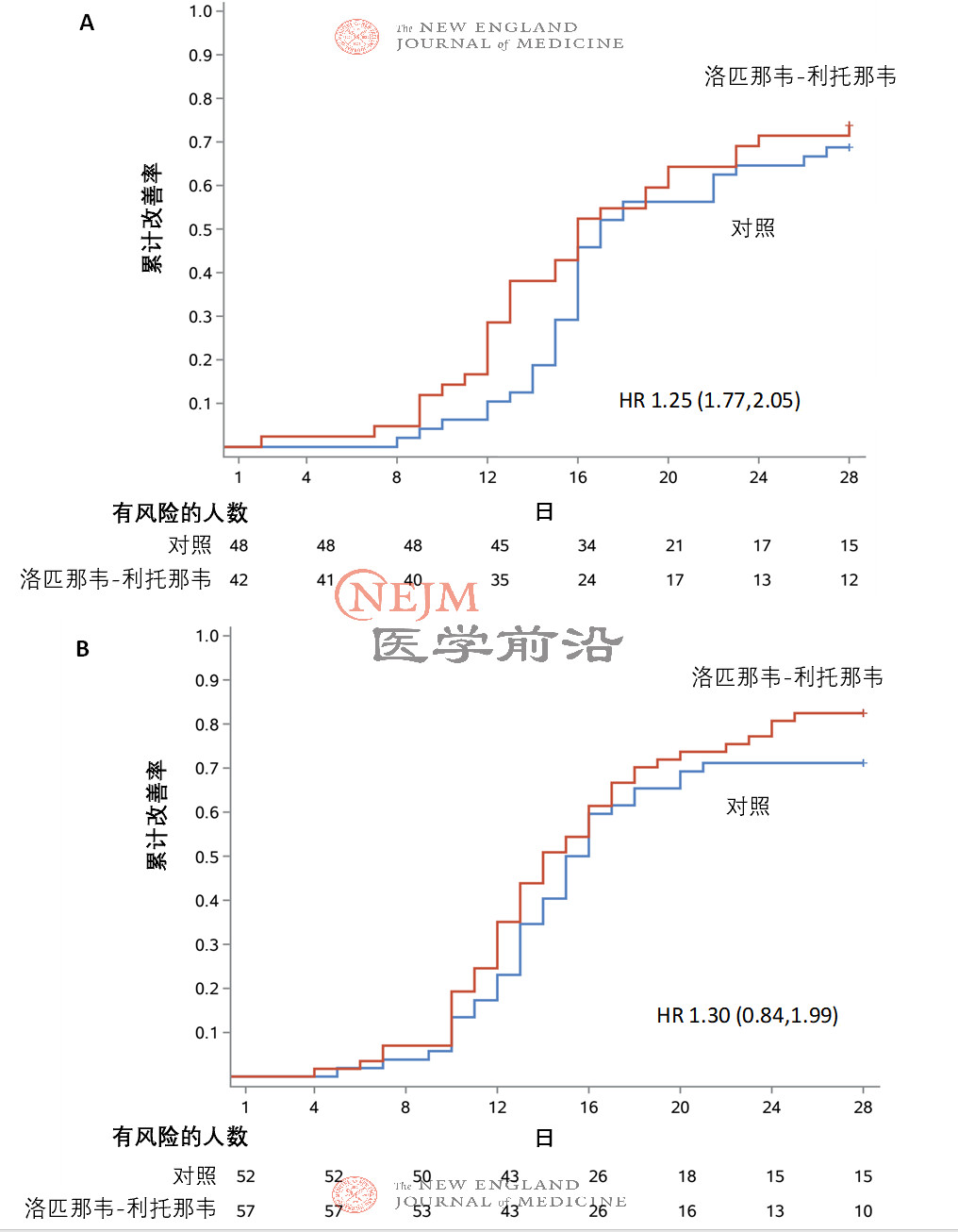
图S2. 意向治疗人群中按照患病时间(≤12天[图A] vs. >12天[图B])绘制的至临床状况改善时间的Kaplan Meier曲线。

图S3. 意向治疗人群中按照疾病严重程度(NEWS2评分>5分[图A] vs. ≤5分[图B])绘制的至临床状况改善时间的Kaplan Meier曲线。
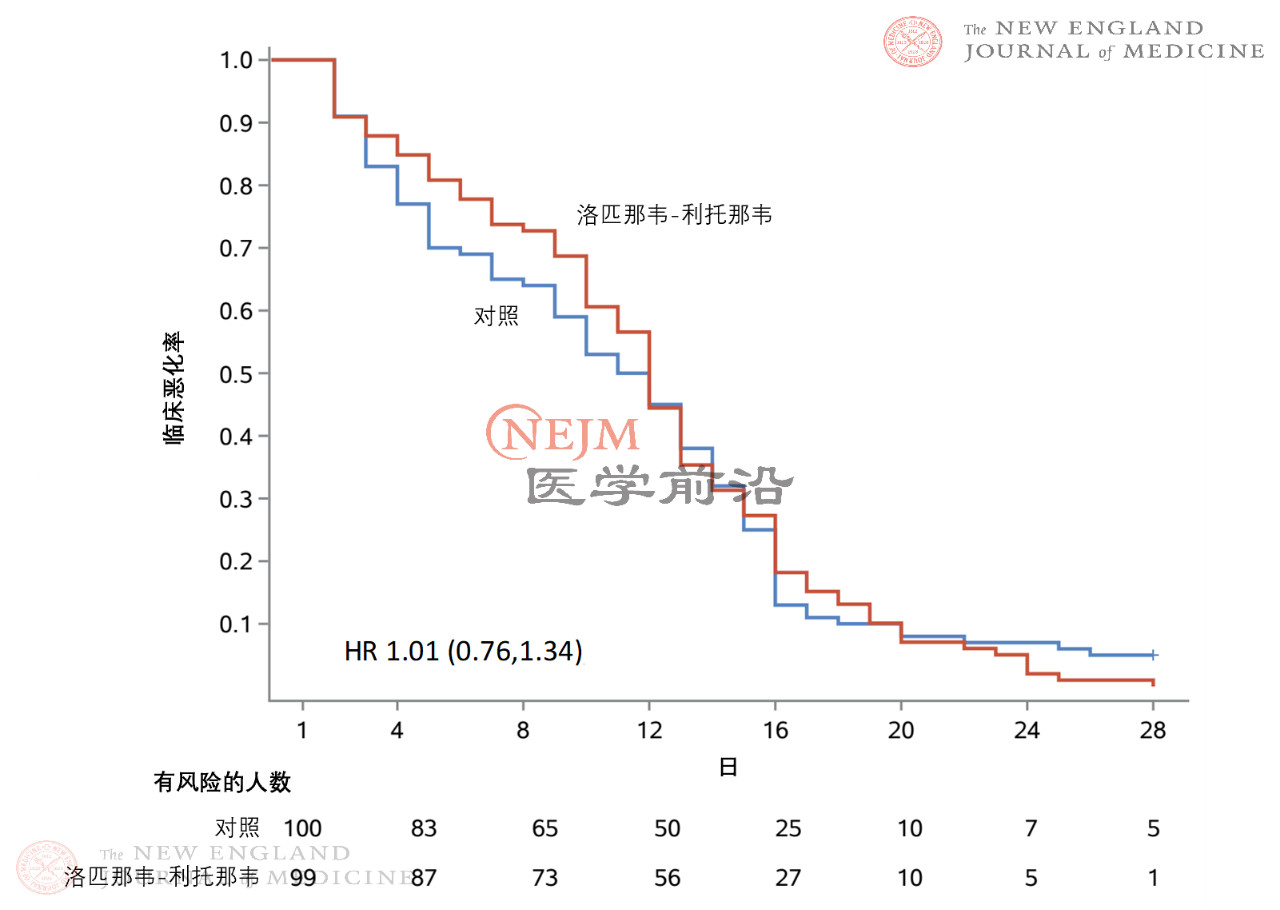
图S4. 意向治疗人群中至临床状况恶化时间的Kaplan Meier曲线。
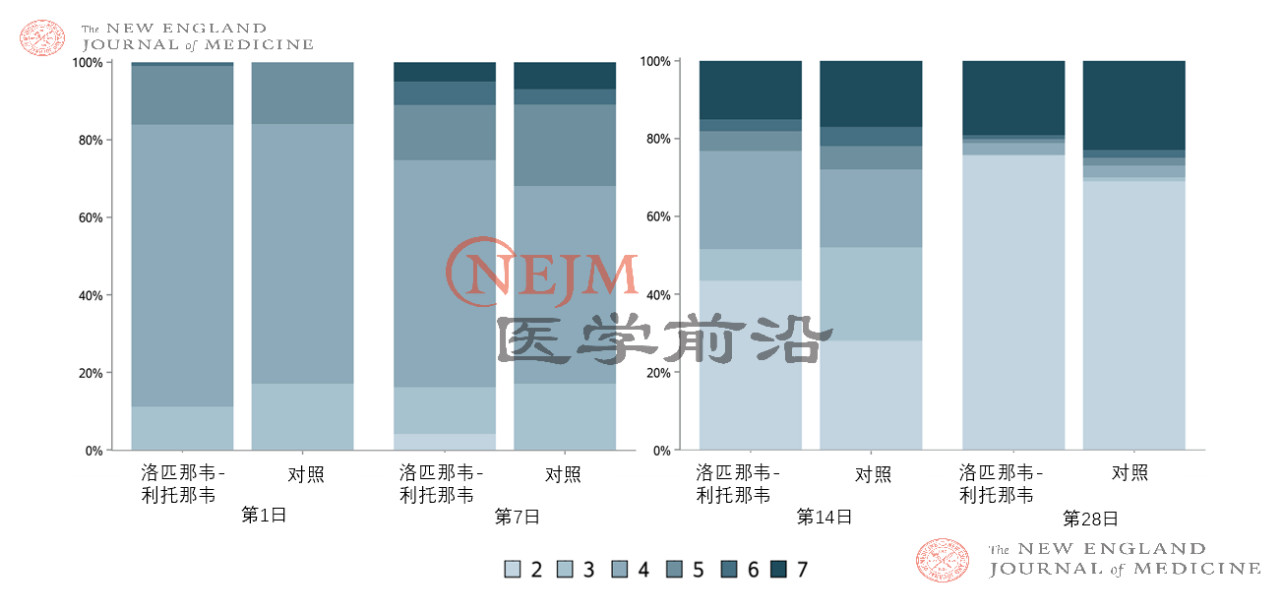
图S5. 意向治疗人群中第1、7、14和28日时主要终点分类的比例分布。
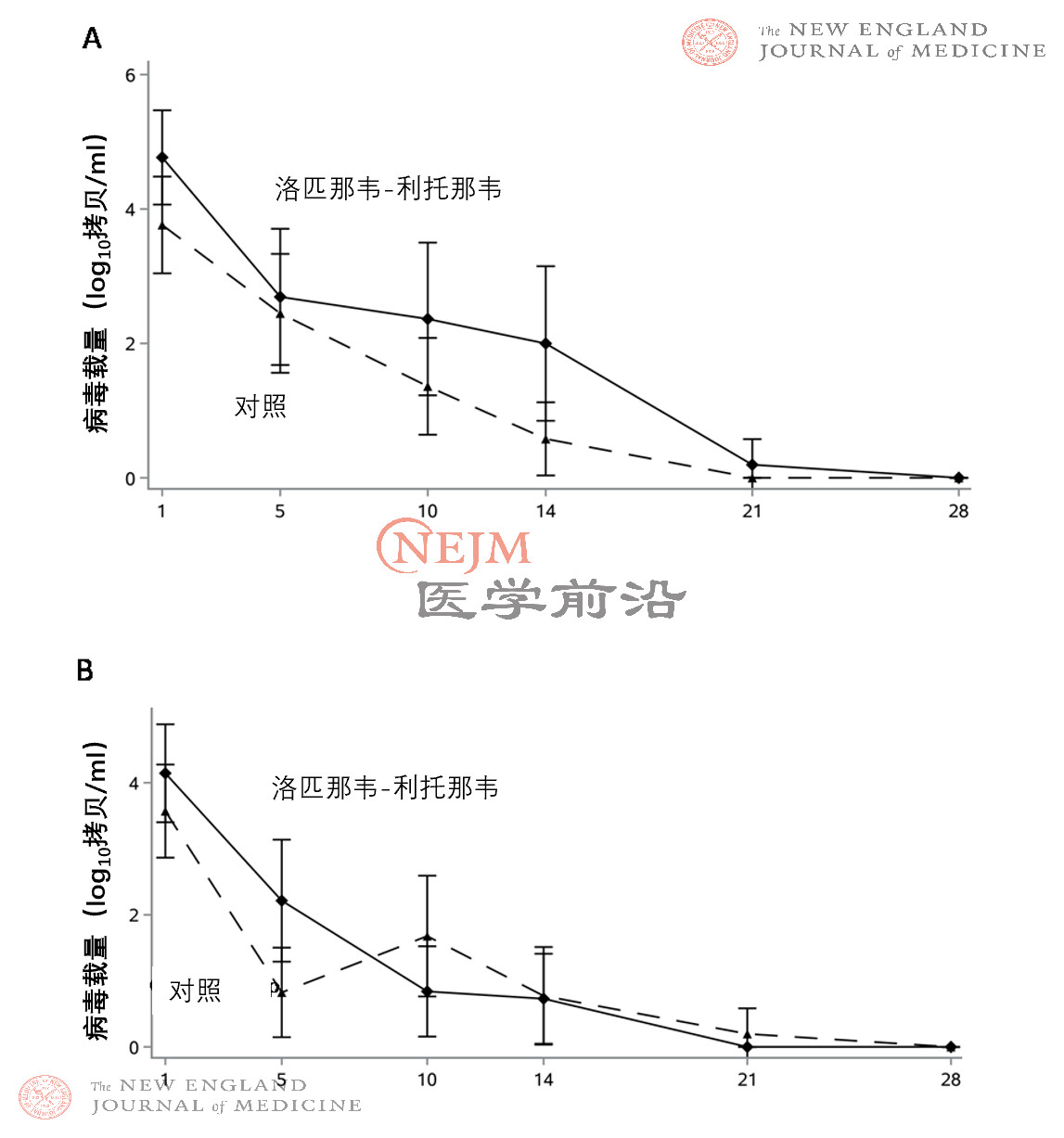
图S6. 改良意向治疗人群中按照患病时间(≤12天[图A]vs. >12天[图B])绘制的随时间推移,通过qPCR检测的咽拭子(病毒阳性人群)SARS-CoV-2病毒RNA载量相对于基线的变化。