当地时间2月25日,美国国立卫生研究院(NIH)宣布启动Remdesivir(谐音被直译为“人民的希望”)治疗COVID-19临床试验。试验的监管发起人是美国国立卫生研究院下属的美国过敏和传染病研究所(NIAID)。
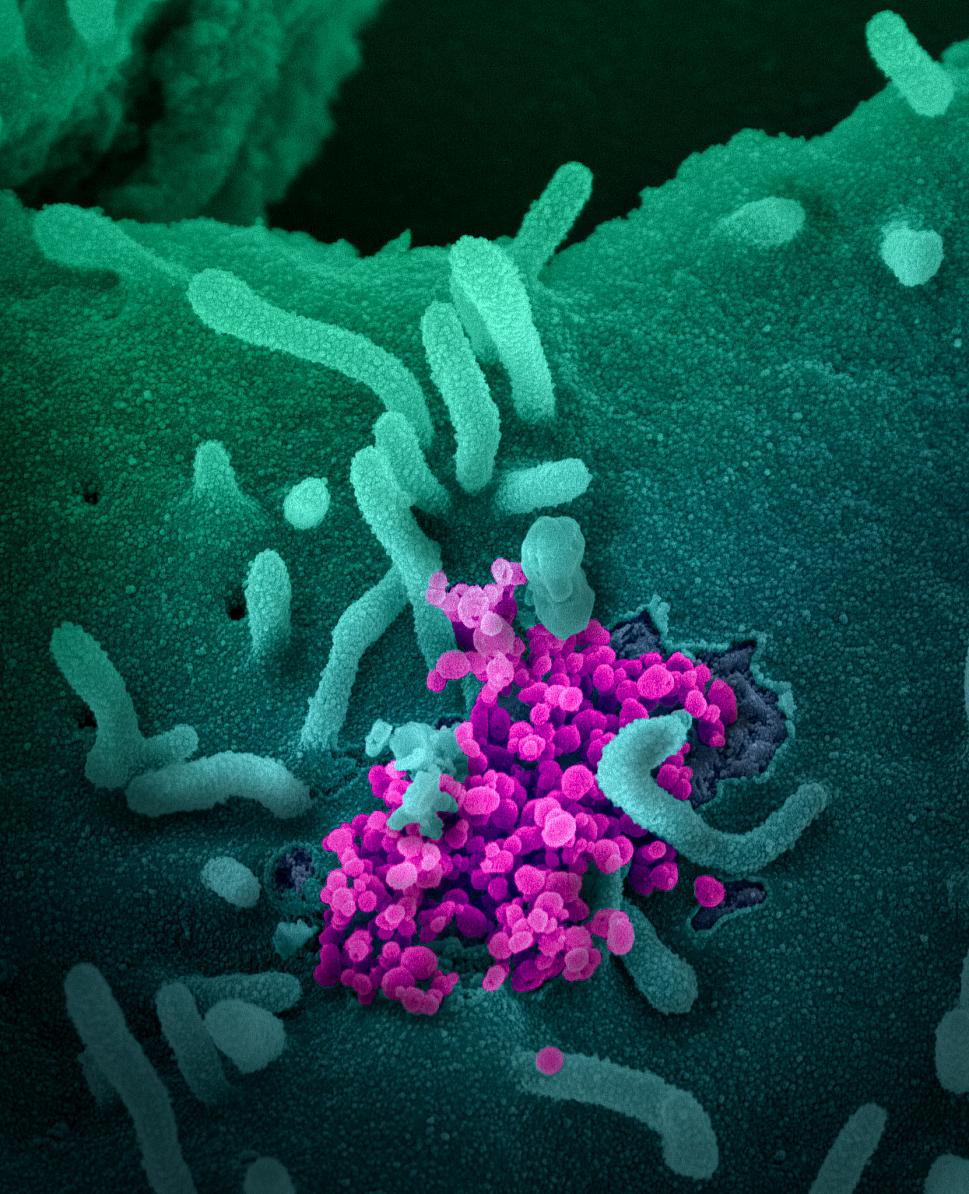
新型冠状病毒(SARS-CoV-2,图中圆形洋红色)
正如美国临床试验数据库(ClinicalTrials)官网数据显示,这是一项适应性、随机、双盲、安慰剂对照试验(NCT04280705),以评估研究性抗病毒药物Remdesivir在被诊断患有冠状病毒病2019(COVID-19)的住院成年人中的安全性和有效性。该试验研究是多中心试验,将在全球多达50个研究中心进行,预计招募394位参试者。
这也是美国启动的首个评估COVID-19治疗的临床试验。COVID-19目前尚无批准的特定疗法。 2020年1月31日,国际顶级医学期刊《The New England Journal of Medicine》发布的一项新报告显示,美国一位确诊新型冠状病毒的患者接受Remdesivir治疗后好转。
clinicaltrials网站
Remdesivir是由吉利德科学公司(Gilead Sciences Inc.)开发的一种在研广谱抗病毒药物,尚未在全球任何国家获得批准。Remdesivir在体外和体内动物模型中证明了对MERS和SARS病毒病原体的活性,它们也是冠状病毒,在结构上与SARS-CoV-2类似。针对MERS和SARS有限的临床前数据表明,Remdesivir可能对SARS-CoV-2具有潜在的活性。
“我们迫切需要对COVID-19进行安全有效的治疗。尽管Remdesivir已被用于部分COVID-19的患者,但我们没有可靠的数据表明它可以改善临床结局,” NIAID主任兼美国冠状病毒工作组成员Anthony S. Fauci医师说,“随机、安慰剂对照试验是确定实验性治疗是否可以使患者受益的黄金标准。”
NIAID根据WHO召集的针对COVID-19患者的治疗性试验的开发,在考虑了这些设计的基础上开展了当前的研究。所有参与者必须是实验室确诊的SARS-CoV-2感染并有肺部感染。被确诊有轻度感冒样症状或无明显症状的确诊感染者将不包括在研究中。根据标准临床研究方案,合格的患者将提供知情同意书以参加试验。
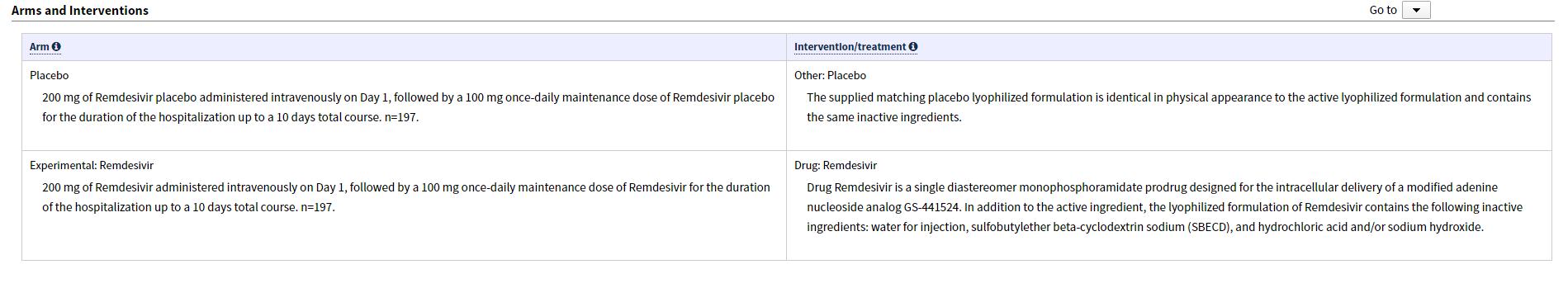
clinicaltrials网站
所有潜在的参与者在接受治疗之前都将接受基线身体检查。然后将合格的研究参与者随机分配到研究治疗组或安慰剂组。在参加研究的第一天,研究治疗组的参与者将静脉注射200毫克(mg)的Remdesivir。住院期间每天再接受100毫克的药物,总共10天。安慰剂组将接受等量的类似于Remdesivir的溶液,但仅含有非活性成分。
临床医生将定期监控参与者,并将根据预定义的临床结果量表(包括考虑温度、血压和补充氧气的使用等因素)对他们进行每日评分。每两天采集一次血液样本以及鼻咽拭子,用于SARS-CoV-2检测。研究人员将在最初15天比较Remdesivir组和安慰剂组的参与者结果,以观察研究药物是否比安慰剂增加了临床益处。
值得注意的是,早在2月初,中国就启动了2项关于Remdesivir的安慰剂对照试验。这些研究结果预计会在4月底完成。美国和中国的两项临床试验设计最大的区别是,美国注册的是“Adaptive COVID-19 Treatment Trial”(适应性新型冠状病毒病治疗试验)的2期临床试验,而中国的两项研究均为3期临床试验。
期待Remdesivir的研究结果,能带来“人民的希望”。
参考资料:
NIH clinical trial of remdesivir to treat COVID-19 begins
Moderna, NIAID Partner on Planned Trial of Coronavirus mRNA Vaccine
Model Considers Coronavirus and Contagious Disease Spread as Complex Interactions
Remdesivir治疗新冠肺炎临床试验在美国正式启动