这篇论文以“AAV9-mediated telomerase activation does not accelerate tumorigenesis in the context of oncogenic K-Ras-induced lung cancer”为题发表在《PLoS Genetics》杂志上,由CNIO Maria A. Blasco领导的端粒和端粒酶组研究组所发现。在这项研究中,CNIO研究者还与巴塞罗那自治大学基因治疗中心(CBATEG)的Fàtima Bosch进行了合作。
最新研究发现
多年来,CNIO端粒和端粒酶组一直在研究利用端粒酶治疗端粒缩短相关的病理过程,以及与衰老相关的疾病(心血管和神经退行性疾病等)。2012年,他们设计了一个高度创新的策略:使用腺相关病毒(AAV)重新激活端粒酶基因的基因疗法。这些基因治疗载体并没有被整合到宿主细胞的基因组中,因此端粒酶仅在载体被稀释之前的几次细胞分裂过程中发挥其端粒修复作用。通过这种方式,与端粒酶激活(如促进癌症)相关的潜在风险被最小化。但是到什么程度呢?端粒酶在医学上的潜在用途仍然被质疑。
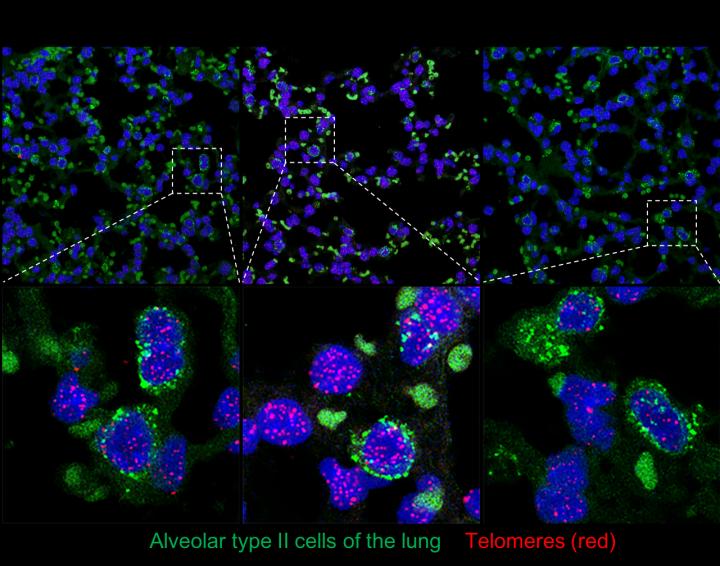
现在发表的这篇论文给出了答案。研究者将基因疗法应用在患有类似人类肺癌的小鼠动物模型上,结果发现,通过这种基因疗法激活端粒酶不会增加患癌症风险。
Blasco指出:“这些发现表明,端粒酶基因疗法似乎是安全的,即使是在肿瘤发生前的情况下。在我们的研究中,我们已经看到这种基因疗法不会增加患癌症的风险,但我们想要进行一项所谓的‘杀手级实验(killer experiment)’,即这个实验为你的假设成立创造了最坏的条件;如果它能在这种情况下存活下来,那么这个假设就是真的成立的。这就是为什么我们选择了这些小鼠;它们会自发形成一种非常类似于人类的肺癌,这通常在正常的小鼠中不会出现。我们想不出还有什么实验能更好地证明这种疗法的安全性。”
如何使用双刃剑
我们知道,端粒位于染色体的末端,在人体每个细胞的细胞核中;随着细胞的分裂,端粒变得越来越短,当缩短过度时,细胞就停止分裂,而它们所衍生的组织不再再生。端粒缩短在衰老过程中起着关键作用:无论是在动物模型中还是在人类中,个体年龄越大,端粒越短。事实证明,与端粒相关的基因突变会导致一系列被称为“端粒综合征”的疾病,包括再生障碍性贫血和特发性肺纤维化。
端粒酶(Telomerase)是修复端粒的酶,我们都有产生它的基因。一般来说,端粒酶只在胚胎发育期间活跃(尤其是在所谓的多能细胞中),但出生几天后,它的表达就被抑制了。在健康的成年人中,大多数细胞不含有端粒酶:它们的端粒在每次细胞分裂后都无法修复,这就是为什么成年人的端粒比年轻人短的原因。有一个例外,那就是癌细胞,它的端粒酶是活跃的,这实际上也是癌细胞大量分裂的原因之一,它们的端粒从未缩短到足以停止分裂,因此,癌细胞实际上是“不朽”的。
端粒酶一直被视为一把双刃剑。通过修复端粒,我们可以防止衰老引起的一系列疾病,但它也可能有利于未检查的肿瘤分化,从而导致癌症。
CNIO的研究人员已经见证了端粒酶的作用。在2001年,他们创造了第一个表达成人端粒酶的转基因小鼠,他们发现随着年龄的增长,癌症的发病率可能会略微增加。但在2008年,他们证明了端粒酶转基因动物的衰老速度更慢,寿命也会延长40%,除了表达端粒酶外,它们对癌症的抵抗力更强。但这种策略不适用于人类,因为它需要从胚胎阶段修改基因组。
所以,还是基因疗法适用于人类,它能在需要端粒酶的地方激活端粒酶。到目前为止,研究人员已经成功证明,端粒酶的基因治疗在抗心肌梗死的小鼠身上是有效的,有助于心脏组织再生、再生障碍性贫血和特发性肺纤维化。
在所有病例中,端粒酶基因治疗都被认为具有治疗效果,尤其在肺纤维化的病例中,端粒酶能够阻止这种疾病在动物模型中的进展,这可能是最令人惊叹的结果之一。尽管接受基因治疗的小鼠都没有发生更多的癌症,但CNIO小组希望进行一项实验以消除任何疑虑,并使其能够证明基于端粒酶的安全治疗是可能的,以便加速端粒酶在治疗目前无法治愈的疾病上的临床应用。
责编:风铃
参考资料
Gene therapy vectors carrying the telomerase gene do not increase the risk of cancer