周二,笔者与大家分享了Cell旗下Immunity杂志近期发表的题为“Resistance Mechanisms to Immune-Checkpoint Blockade in Cancer: Tumor-Intrinsic and -Extrinsic Factors”的综述。作者们汇总了导致免疫检查点阻断疗法在不同患者中存在治疗差异的肿瘤内在和外在相关的多项因素。
文章指出,尽管这一类疗法取得了前所未有的成功,但不可忽视的是,依然有很大一部分患者群体对该疗法不响应。近两年,科学界和产业界对开发基于免疫检查点抑制剂的联合疗法饱含浓厚的兴趣,包括Opdivo、Keytruda以及Tecentriq在内的获批“明星药物”都有大量的在研联合策略。
不久前,百济神州高级副总裁杨建新博士在一次报告中强调,从目前来看,联合治疗将是免疫疗法未来发展的必然趋势之一,但是究竟如何进行联合用药(跟什么联合、一起用药还是前后用药等),疗效和毒性会如何,患者能否承担联合疗法的价格,这些问题都需要去解决。PD-1抗体等免疫疗法可找的“搭档”包括靶向疗法、免疫抑制/刺激分子、疫苗、化疗、放疗等。【详细】
5月20日,Cell旗下Trends in Immunology在线发表了一篇题为“Targeted Therapy and Checkpoint Immunotherapy Combinations for the Treatment of Cancer”的综述,作者们讨论了针对MAPK和VEGF信号通路的靶向疗法的免疫调节作用,以及如何将这类靶向疗法与PD1/PD-L1抗体以及 CTLA-4抗体进行联合。
同时,文章还批判性地考察了支持靶向-免疫联合疗法的基本原理,并讨论了这些组合方案的临床前和临床数据。作者们希望通过梳理这些相关的近期研究为癌症治疗提供了可参考的联合疗法框架。
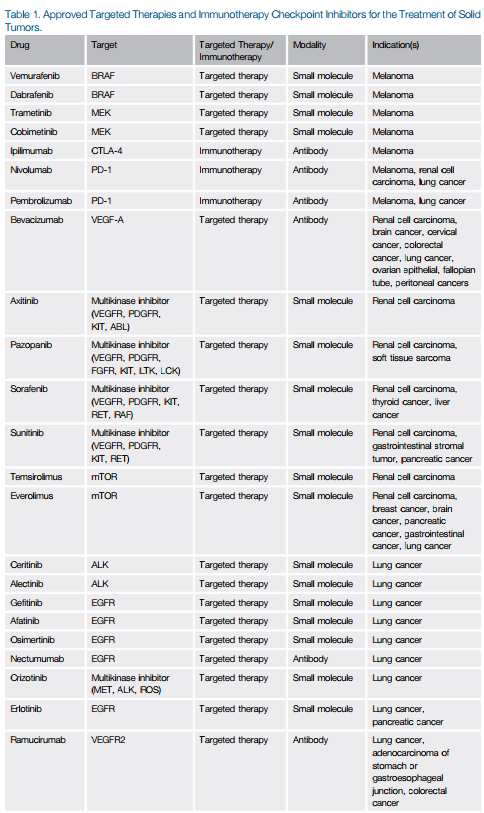
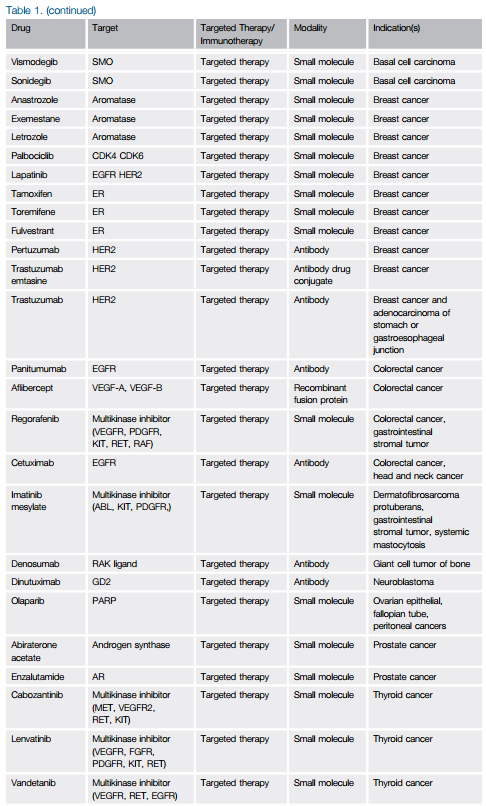
过去的15年里,癌症治疗取得了显著的进展,许多科学进步在这其中扮演了重要的角色。在这期间,抑制肿瘤血管生成以及癌细胞生长内在驱动因子的靶向疗法,以及增加宿主抗肿瘤免疫力的免疫调节疗法相继获得监管机构的批准(表1)。
据介绍,靶向疗法能够在多种肿瘤类型中引起显著的临床反应,但这些反应是短暂的,且在初始响应后的几个月内会伴随肿瘤逃逸和临床复发的发生。相比之下,癌症免疫疗法也可应用于多种肿瘤,并可在部分患者中产生持久响应。该特点导致了这一领域在近几年爆发出大量的临床前研究和临床开发项目。
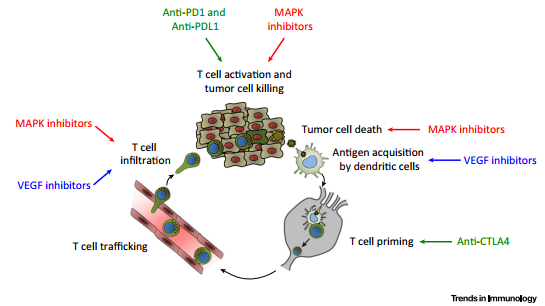
图1
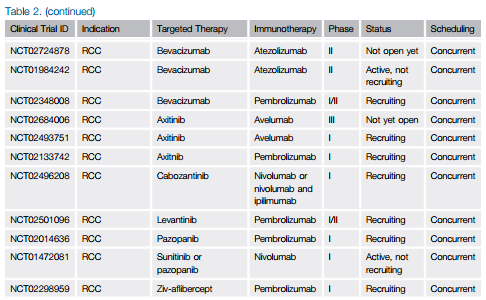
上图(图1)概括了抗肿瘤免疫响应中涉及的关键步骤,简称“癌症—免疫循环(cancer-immunity cycle)”。目前,有大量正在进行的临床试验结合了靶向疗法及免疫调节疗法(表2)。支持这些联合疗法的基本依据是两种疗法靶向了不同的增强抗肿瘤活性的免疫学和肿瘤生物学机制;此外,一些证明表明,靶向疗法能够增强“癌症—免疫循环”中的某些环节,这为两者的联合提供了另一种依据。

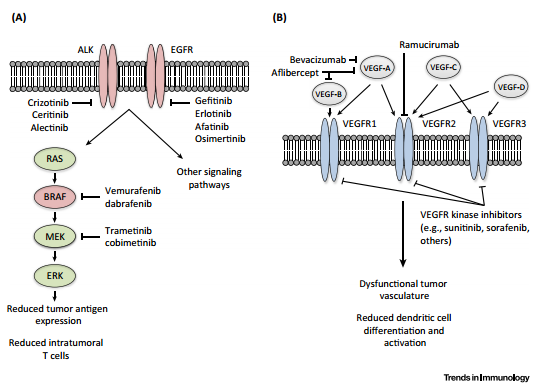
在这一综述中,作者们着重讨论了两个例子,即针对MAPK通路和VEGF通路的靶向疗法。它们不仅能够对癌细胞生长和肿瘤血管生成产生直接的影响,还能够影响肿瘤抗原性以及瘤内T细胞浸润。这些靶向疗法对宿主免疫响应的影响超出了它们对肿瘤生物学的作用范畴,为将它们与免疫调节T细胞检查点疗法结合提供了强有力的依据。
综述第一部分内容简要回顾了T细胞检查点疗法的发展,包括PD-1/PD-L1抗体、CTLA-4抗体等。作者们指出,检查点抑制剂的抗癌作用与肿瘤抗原性以及瘤内T细胞的相关性预示着,科学家们或许可以将影响这些因素的药物与检查点疗法(Checkpoint Therapies)有效联合。随后,第二、第三部分内容详细介绍了MAPK通路抑制剂、VEGF通路抑制剂与检查点疗法的联合策略。
第四部分内容中,作者们总结了“靶向-检查点联合疗法”临床开发时应考虑的一些关键因素,如优化给药方案、最小化治疗相关毒性、选择合适的结点(endpoints)评估疗效。据介绍,目前,同时给药和先后给药的管理方式都在临床试验中进行评估。其中,同时给药的管理方式表现出了明显的优势,具有产生最大化协同相互作用的潜力,尤其是可形成一个良性循环,即靶向疗法可驱动肿瘤抗原呈递、T细胞浸润以及PD1/PDL1表达,从而为肿瘤响应检查点抑制剂作准备。然而,同时给药需要考虑的一点是,靶向疗法是否会抑制患者免疫响应,特别是T细胞功能。
结论
在这一综述中,作者们提出了靶向疗法与免疫疗法的联合框架,并指出,靶向疗法能够通过增强癌症-免疫循环中的一些环节(如肿瘤抗原性、T细胞启动/运输/浸润等)对免疫疗法起到协同增强作用。他们认为,靶向疗法对宿主免疫力的影响可被用于指导和优化更多“靶向-免疫联合疗法”的开发。