前列腺癌是男性发病率最高的癌症之一,并且在治疗方面仍有巨大的改善空间——目前仍然缺乏靶向且对健康组织危害小的疗法,尤其是在当癌症已扩散的情况下。造成这一现状的主要原因之一在于:大多数前列腺肿瘤都存在高度异质性的特点,使得任何靶向药物在单独使用时都难以解决所有问题。
来自美国布莱根妇女医院和约翰霍普金斯大学的研究者们提供了一种新的思路:他们以间充质干细胞(MSC)为载体,将药物微粒输送到肿瘤处,然后释放出仅会在前列腺肿瘤处被激活的药物前体——就像深入敌营的“特洛伊木马”一样——靶向清除肿瘤。
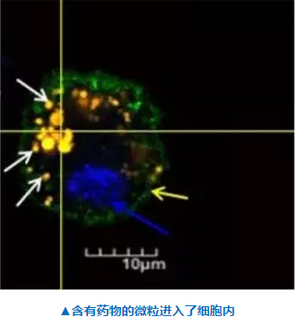
具体来说,研究者采用了一种基于化疗药物毒胡萝卜内酯(thapsigargin)设计出的可被前列腺特异抗原(PSA)激活的大分子药物前体G114,后者被包裹在聚乳酸-羟基乙酸共聚物(PLGA)里,形成直径约950纳米的微粒。接着,这些微粒将在体外被间充质干细胞吞噬,间充质干细胞具有天然的向肿瘤迁移的能力。对于具有组织修复功能的间充质干细胞来说,肿瘤就好像是永不愈合的伤口,因为肿瘤也会释放多种炎症因子,而且是持续性的,从而会不断的吸引间充质干细胞前来“江湖救急”。而藏于它们中的药物前体微粒此时一旦被释放出来,就会被前列腺肿瘤所固有的PSA激活,成为深入肿瘤的“特洛伊木马”。这些被激活的药物将作用于整个肿瘤——不管PSA是否表达于所有的肿瘤细胞——而不会像靶向药物那样只会作用表达特定标记的特定肿瘤细胞。对于正常组织,只要没有同时表达PSA和释放大量炎症因子,理论上就不会被这些“特洛伊木马”所伤害。
目前,研究者们已在CWR22前列腺肿瘤异体移植动物模型中证实了这一方法的抗癌效果,其结果发表在近期的《Biomaterials》期刊上。
“间充质干细胞是一种极具前景、可被优化改造的肿瘤靶向性药物载体,” 文章共同一作之一Oren Levy博士说道:“通过向这些细胞装载具有强大杀伤力的化疗药物,我们设计出了一种基于细胞载体、专门向癌症病灶处递送药物的‘特洛伊木马’。”
“这里的药物前体只会在肿瘤微环境中被激活,为该靶向药物递送系统又增添了一个层面的特异性机制,” 文章的通讯作者之一John Isaacs博士评价道。
在未来,研究者们计划拓展这一采用特定细胞装载药物微粒的技术的应用范围,使其可用于治疗包括癌症和神经退行性疾病的多种疾病。
参考资料:
[1] Cellular Trojan horse yields potential cancer treatment
[2] A prodrug-doped cellular Trojan Horse for the potential treatment of prostate cancer
[3] Mesenchymal stem cells: a new trend for cell therapy