纳米材料的生物医学应用能显著主要是由于其独特的物理性质、高的比表面积和多价结合能力。尽管在生物医学研究有了连续性的突破飞跃,关键的挑战仍然是设计有针对性的纳米试剂,能够选择性定位在特定疾病,特别是肿瘤的早期诊断和有效治疗。随着纳米精准医学的发展,将纳米结构为基础的试剂导入到肿瘤靶向区域仍然是临床上的一个关键挑战。
一个新兴的策略是以实现高靶向选择性为目标,通过共轭的纳米材料与亲和配体、包括小的有机部分或具有生物活性的分子,和肿瘤细胞的受体结合。然而,不同表达水平的受体,复杂和动态的生理细胞环境可能会造成这种配体介导的肿瘤亲和力的非特异性识别的问题。因此,更进一步靶向治疗的要求是要求不完全依赖于受体,来区分肿瘤和正常细胞。
在1月20日的Nature Communication中,来自新加坡南洋理工大学的邢本刚(Bengang Xing),新加坡科技研究局的Malini Olivo和厦门大学的刘刚教授等人的研究团队提出了一个独特的微环境敏感的策略,可以将能成像的纳米晶体(UCNs) 定位在肿瘤区域。在肿瘤特异性蛋白酶反应中,肽的裂解导致相邻的半胱氨酸和2--氰基苯并噻唑之间的共价交联,从而触发纳米晶体(UCNs)积累到肿瘤部位。这种酶引发UCNs交联可以导致在808 nm激光照射转换发射增强。重要的是,这种设计使瘤内注射或配体修饰纳米粒子靶向静脉注射的肿瘤抑制作用都很显著。该文章为有效的分子检测和定位肿瘤治疗综合解决方案提供了战略。
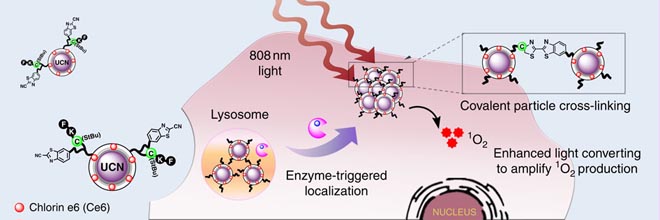
在这项工作中,不同的过程涉及的是非特异性的肿瘤靶向,这样独特的平台,可以响应肿瘤特异性酶并进行交联反应,从而促使选择性肿瘤的积累。更重要的是,这与不能进行交联反应的粒子相比,酶触发共价交联具有增强在808 nm照射时光转换发射。这样的增强可以从负载在颗粒表面的光敏剂上有效放大活性氧(O2)的生产。从而在多模态成像和光动力肿瘤治疗(PDT)治疗恶性肿瘤中,在808 nm照射下表现出独特的粒子定位。因此给出了光动力肿瘤治疗(PDT)以及体外和体内无创荧光和光声成像的纳米药物的前景。这明确的合理的设计可以很容易地扩展到其他独特的功能材料和开发新的未来临床应用。