目前,全世界有3500万人携带艾滋病毒,但是大多数需要艾滋病药物的人却没有条件和途径得到治疗。与2001年新增340万病例相比,2013年新增病例为210万人,降低了38%。其中75%的感染者主要集中在15个国家,例如撒哈拉以南的非洲,尼日利亚、南非和乌干达三个国家的新增艾滋病感染人数占总数的48%。
在过去的三年里,因艾滋病死亡的人数也降低了20%,每年减少150万人。其中,南非和埃塞俄比亚改善状况最为显著。根据联合国艾滋病规划署的报告,人类有望于2015年后终结艾滋病的流行,并在“2030年终结艾滋病”。
为了实现这一愿望需要世界各国政府、组织机构的共同努力,当然这其中也少不了一直从事着艾滋病研究的科学家们。今天是世界艾滋病日,小编在此为大家盘点十二项近期科学家们在艾滋病领域的突破研究。
Nature Medicine:新型艾滋病疗法(11月24日)
11月24日,发表在《Nature Medicine》杂志上的一项研究中,科学家们利用一些抗体来遮掩免疫细胞阻止T细胞运输到肠道中,可以大大降低HIV感染的非人类灵长类动物模型中病毒传播的风险。研究结果表明,一些已用于炎性肠病临床试验中的药物有可能可以有效地治疗或阻止HIV感染。
肠道中的CD4+ T细胞是HIV感染过程中早期关键的靶标,CD4+ T细胞耗竭是疾病恶化的一个预兆。通过利用一种抗α4β7整合素(integrin)抗体研究人员设法“掩盖”了这些细胞。a4b7整合素分子可以促进这些T细胞归巢到肠相关淋巴组织。这种抗体不会清除T细胞,而只会阻止它们归巢肠道,并阻碍了它们与传染性病毒互作。
在以往的一项研究中,研究人员曾调查了抗α4β7治疗对于急性SIV感染的影响,发现其不仅可以抑制病毒载量,还可以让治疗动物数年维持健康,而对照动物的SIV感染则发展成了艾滋病。
这项研究中,研究人员经阴道让雌性恒河猴每周重复感染一次HIV的同源物SIV,然后在这一模型中检测了靶向α4β7的效应。结果12只对照动物有10只被SIV感染,而12只a4b7抗体治疗动物中只有一只到第五周时受到感染。5只在第8周时受到感染,有6只仍然未被感染。研究人员计算出,抗α4β7治疗将每次感染的风险降低了2.7倍。研究人员还观察到,α4β7抗体治疗动物肠组织中的病毒以及子宫颈组织中残余病毒的水平均下降。他们认为这表明离开感染点的病毒传送受到了抑制。[详细]
Clinical Microbiology and Infection:HIV感染自愈揭秘 艾滋病疗法新的希望(11月4日)
就在艾滋治疗遭遇“密西西比女婴”滑铁卢之后,近日,两名男性HIV病毒携者“功能性自愈”,这让艾滋病研究者们重新振奋起来。数月前,被人们亲切称为“密西西比女童”的艾滋女婴,在停止抗逆转录病毒药物治疗后,体内重新检测出艾滋病病毒。艾滋病研究重新出现一片阴霾。然而,研究者发现这两名艾滋病患者是通过自身特殊的遗传机制而功能性自愈。
来自法国卫生与医学研究所的研究人员称,事实上,这两名艾滋患者并非独有的案例,早在数年前第一位艾滋病患者——法国人布朗功能性自愈,也同其自身独特的遗传变异有关,这两位艾滋病患者也携带有该独特的遗传变异。[详细]
Nature揭示HIV惊人发现(11月2日)
近日,发表在《自然》杂志上的一项研究中,欧洲分子生物学实验室(EMBL)的科学家以及来自海德堡大学的合作者们,获得了第一个极高分辨率的不成熟HIV的结构,并精确地描绘出了每个构件位 于病毒中的确切位置。这一研究结果揭示出不成熟HIV的构件按照一种惊人的方式进行排列。
该研究工作的领导者、欧洲分子生物学实验室的John Briggs说:“这一结构与我们预期的完全不同。我们猜想,像HIV和梅森-菲舍猴病毒(Mason-Pfizer monkey virus)一类的逆转录病毒会具有相似的结构,因为它们利用了如此相似的一些构件,但结果表明,它们的不成熟形式相互之间有着惊人的差别。在这一点上, 我们真的不知道其原因。”[详细]
Science & Nature:HIV表面蛋白呈动态 像跳舞一般(10月8日)

10月8日,发表在《科学》杂志上的一项研究中,来自威尔康乃尔医学院的科学家们发明了一项新技术,它让研究人员第一次看到了人类免疫缺陷病毒(HIV)表面包膜蛋白的动态过程。同一天,《自然》杂志也刊登了该研究的另一部分成果,论文描述了HIV蛋白构象的三维结构。
威尔康乃尔医学院的副教授Scott Blanchard说:“该技术有望为预防HIV感染开辟新的途径。”通过可视化HIV的运动过程,我们可以实时观测病毒表面蛋白的行为,从而告知我们如何预防病毒侵入人体细胞。《科学》上的论文显示出该技术能够展现出病毒表面蛋白的实时动态图像,研究人员正计划筛选出有效的药物和抗体来关闭该过程。[详细]
Cell:揭秘艾滋病广泛中和抗体家族(9月25日)
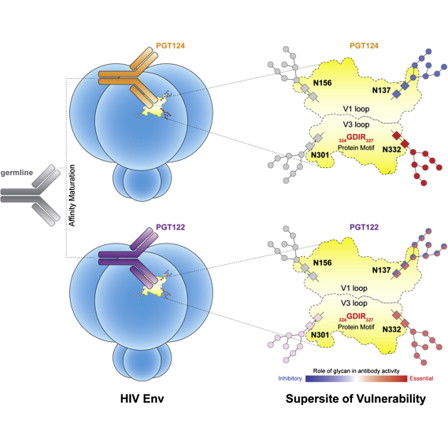
来自斯克里普斯研究所(TSRI)的科学家们发现,一个可广泛中和不同HIV病毒株的抗体家族演变出了显著不同的结构来攻击病毒上的一个脆弱位点。研究结果为未来的HIV疫苗设计提供了一些新线索。相关论文在9月25日《细胞》(Cell)杂志上。
斯克里普斯研究所Skaggs化学生物学研究所成员、结构生物学教授Ian A. Wilson说:“从某种意义上讲,这一抗体家族向目标发动了不止一次打击,击中了不同形式的HIV。”[详细]
PLOS Pathogens:揭开首例艾滋病治愈者之谜(9月25日)

2014年9月25日在《PLOS Pathogens》发表的一项研究,报道了一种新的灵长类动物模型来检测可能治愈艾滋病的治疗方法,并解答了“柏林病人”所提出的一些问题。
“柏林病人”蒂莫西•雷•布朗是一名美国白血病患者,并同时患有艾滋病。2007年他来到柏林找到了胡特医生,当时布朗的状态非常不好,病情正在恶化,几乎已经到了死亡的边缘。随即胡特做出一个决定:进行骨髓移植,先治白血病。结果却出人意料,经过3年来的临床观察,这次移植同时治愈了布朗的艾滋病。原来骨髓捐献者的配型不仅非常吻合,而且骨髓中还有一种能天然抵御艾滋病病毒的变异基因。据以往研究发现,这种变异基因只在少数北欧人体内存在。[详细]
PNAS:被动免疫疗法有望结束HIV的潜伏(9月9日)
9月9日,发表在《美国国家科学院院刊》(PNAS)杂志上的一项研究中,美国NIH国立过敏与传染病研究所的科学家们进一步强调了HIV被动免疫疗法的重要性。他们的研究表明,在停止抗病毒治疗之后,被动免疫疗法可以继续抑制HIV病毒。
在这项研究中,NIH的研究团队募集了29名HIV患者,这些患者接受的抗病毒治疗已经完全抑制了HIV的病毒复制。研究人员从这些患者体内收集了潜伏的HIV,他们发现一些bNAb(特别是PGT121、VRC01和VRC03)能够有效阻止这种HIV进入健康的CD4+ T细胞。此外,这些抗体还能够在HIV感染者的CD4+ T细胞中完全阻断HIV的复制。
研究人员总结道,用一种或几种bNAb进行被动免疫治疗,可以在停用抗逆转录病毒药物之后,对HIV进行有效控制。现在他们正在计划和开展能够检验这一理论的临床试验。[详细]
Nature:新型高效艾滋病抗体(9月3日)
9月3日,发表在《自然》杂志上的一项研究中,由美国国立卫生研究院(NIH)领导的一个科学家小组,发现了HIV盔甲上可被疫苗、其他预防方案或疗法利用的一个新脆弱点。这一位点跨越病毒外膜两种蛋白:gp41和gp120,为我们增添了广泛中和抗体(bNAbs)结合HIV的新位点。这一新鉴别出的位点定位在病毒刺突上,gp41是HIV病毒的一种跨膜蛋白,gp120位于病毒表面,并与gp41通过非共价作用结合。
科学家们在一名HIV感染者身上发现了结合到了病毒这一位点上的一种新抗体。这种称作为35O22的抗体能以阻止62%的已知HIV病毒株感染实验室的细胞,且其非常的有效,只要相对少量的35O22即可中和病毒。[详细]
PNAS:刘善虑博士发表艾滋病重要研究发现(9月2日)
9月2日,发表在《美国国家科学院院刊》(PNAS)杂志上的一项研究中,来自密苏里大学的研究人员发现,一个促进病毒进入细胞的蛋白质家族也能够阻止HIV和其他病毒的释放。
HIV-1会对机体免疫系统至关重要的一些细胞,如T细胞发动攻击。T细胞在机体的抗感染反应中起重要作用,HIV-1可以破坏这些白细胞的抗感染能力。当病毒进入到宿主细胞中,它会感染细胞并进行复制,生成病毒颗粒,再传播感染其他的细胞。研究人员发现,当病毒颗粒试图从感染细胞中出芽或离开感染细胞时,定位在细胞表面的TIM家族蛋白可以结合病毒颗粒表面上的磷脂酰丝氨酸(PS)。[详细]
Cell重大突破:抗艾滋病组合拳(8月14日)
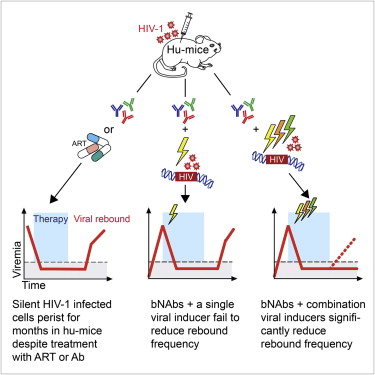
8月14日,发表在《细胞》杂志上的一项研究中,来自洛克菲勒大学的研究人员想出了一种新策略:利用广泛中和抗体的力量对抗HIV,并联合一些化合物来诱导病毒转录,用这种‘慑杀’(shock and kill)方法来攻击潜伏的细胞储存库。在对小鼠的测试中,57%以这种方式治疗的动物在终止治疗后,血液中的病毒均没有像预期的那样再度出现。 [详细]
PNAS艾滋病研究突破:CRISPR技术根除病毒(7月21日)
7月21日发表在《美国国家科学院院刊》上的一篇文章中,研究人员利用基因组编辑技术的精确剪切,将艾滋病毒从人类基因组中剔除。
天普大学的 Kamel Khalili等人采用了CRISPR/Cas9 基因组编辑系统,针对几个人类细胞系,比如小胶质细胞和T细胞进行了研究,从这些细胞中去除了HIV病毒。他们靶向的是病毒的5'和3'末端,也就是长末 端重复序列(LTRs),这样整个病毒基因组都被删除了。[详细]
Science:HIV为何难以攻克?(7月11日)
7月11日,一项刊登在《科学》(Science)的最新研究显示,当艾滋病病毒(HIV)感染某个细胞时,其干扰宿主基因组的位置十分重要,这对于艾滋病毒保持其持久力,以及在之后的时间里,继续感染细胞具有重要意义。领导这一研究的是美国国立癌症研究所艾滋病药物抗性研究项目组Stephen Hughes 博士,这一研究项目组长期从事艾滋病研究,曾发现了 HIV-1 抵抗AZT(叠氮胸苷或齐多夫定,一种广泛用于治疗艾滋病的防护药物)的抗药机理。[详细]