本文转载自“药明康德”。
“Now this is not the end. It is not even the beginning of the end. But it is, perhaps, the end of the beginning.”—— 温斯顿·丘吉尔

陈列平教授是全球免疫疗法当之无愧的先驱,在人类的抗癌史上谱下了多段华章:上世纪90年代,他的团队率先发现了B7-H1(后被称为PD-L1)分子,并证明它在肿瘤免疫逃逸过程中扮演了重要角色;2002年,他的团队又发现通过抑制PD-1与PD-L1的结合,能够增强免疫系统的抗肿瘤能力。这些突破性的贡献直接推动了抗PD-1/PD-L1免疫疗法的开发,彻底改变了癌症的治疗格局。
多款重磅免疫疗法问世之下,业内正尝试不同的免疫疗法组合,以求带来全新的治疗方案。有趣的是,面对这一研发热潮,陈列平教授却坦言“路有些走偏”。在他看来,许多组合并没有科学依据,甚至可以说是在“碰运气”。
“很多根本的科学问题都还没有得到解决,大家就急着涌入临床治疗中去,这是目前的最大问题,” 在药明康德内容团队的专访中,陈列平教授这样说道:“现在的免疫疗法领域有一个不好的趋势,就是大家不愿意讲一些和主流不一样的东西,但我还是想讲讲自己的一些不同看法。”
免疫疗法的序章
使用免疫系统对抗癌症,并不是最近才诞生的新概念。早在100多年前,威廉·科莱(William Coley)医生就曾对癌症患者注射细菌或细菌产物,以求增强免疫系统的活性,治疗癌症。一些资料表明,在他40年的行医生涯里,曾对1000多名癌症患者进行过类似的治疗。在很小一部分患者中,也的确能观察到肿瘤尺寸的缩小,但是治疗带来的毒性,使得治疗无法继续下去。

▲现代不少科学家认为威廉·科莱医生是免疫疗法最早的开拓者之一(图片来源:[CC BY 4.0 ], via Wikimedia Commons)
这可以说是早期癌症免疫疗法的一个缩影:基于“免疫反应不足以抑制肿瘤生长”这一假设,科学家们专注于增强或放大机体全身的免疫反应,让免疫系统对癌症发起攻击。基于这些策略,在过去的几十年里,干扰素、白介素2、抗CTLA-4抗体以及最近新兴的CAR-T细胞治疗,也陆续得到了美国FDA的批准,用于治疗黑色素瘤,肾癌以及一些血液肿瘤等特定的癌症。
但在将上述免疫疗法用于治疗肺癌、乳腺癌、肝癌等临床常见的实体瘤,所有临床试验都以失败告终。“尽管这些疗法都能看到免疫反应的增强,比如T细胞的增多,但在大多病人身上,这些增强的免疫反应和临床效果没有关系,病人的肿瘤照样长,”陈列平教授说道:“所以当时很多人认为免疫系统对治疗癌症没什么用,不少人也撤出了这个领域。我们这批留下来研究免疫疗法的人都是‘死硬分子’。”
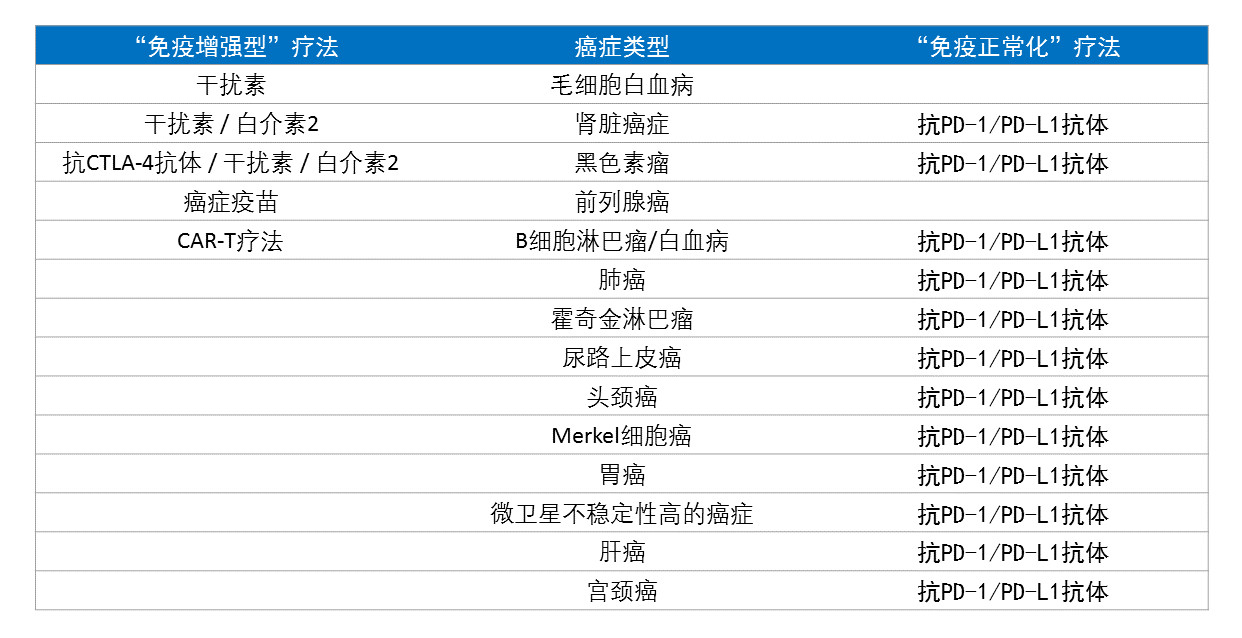
▲FDA批准的癌症免疫疗法以及它们的适应症(数据来源:参考资料[1];制图:药明康德内容团队)
因为相信,所以看见。当时的一些探索者们清楚地看到了“免疫增强型”疗法存在的一些问题——它们只是系统性地增强免疫系统活性,甚至将原本“正常”的活性提高到了“异常”的水平,却不能特异针对肿瘤生长过程中的免疫缺陷。“如果免疫系统和T细胞的激活没有问题,那问题可能出在最后一步,T细胞进不到肿瘤里。所以我们才开始从肿瘤微环境中寻找解决思路。”陈列平教授回忆说。
PD-1/PD-L1通路与组合疗法
如今我们知道,肿瘤之所以能逃脱免疫系统的攻击,一大原因在于肿瘤演化出的多种免疫逃逸机制。在这些逃逸机制的作用下,T细胞的活性会在肿瘤微环境中得到抑制,使肿瘤逃过免疫系统的攻击。
PD-1/PD-L1通路的发现,以及多款抗PD-1/PD-L1重磅疗法的横空出世,重新定义了癌症的治疗格局。由于直击肿瘤的免疫逃逸机制,与“免疫增强型”疗法相比,这类疗法“能够以很高的有效比例治疗广谱肿瘤,而且毒性非常低。”陈列平教授指出,抗PD-1/PD-L1抗体代表了一类全新的免疫疗法——它们不再简单“增强”免疫反应,而是让肿瘤发病过程中出现缺陷的免疫系统“恢复正常”。
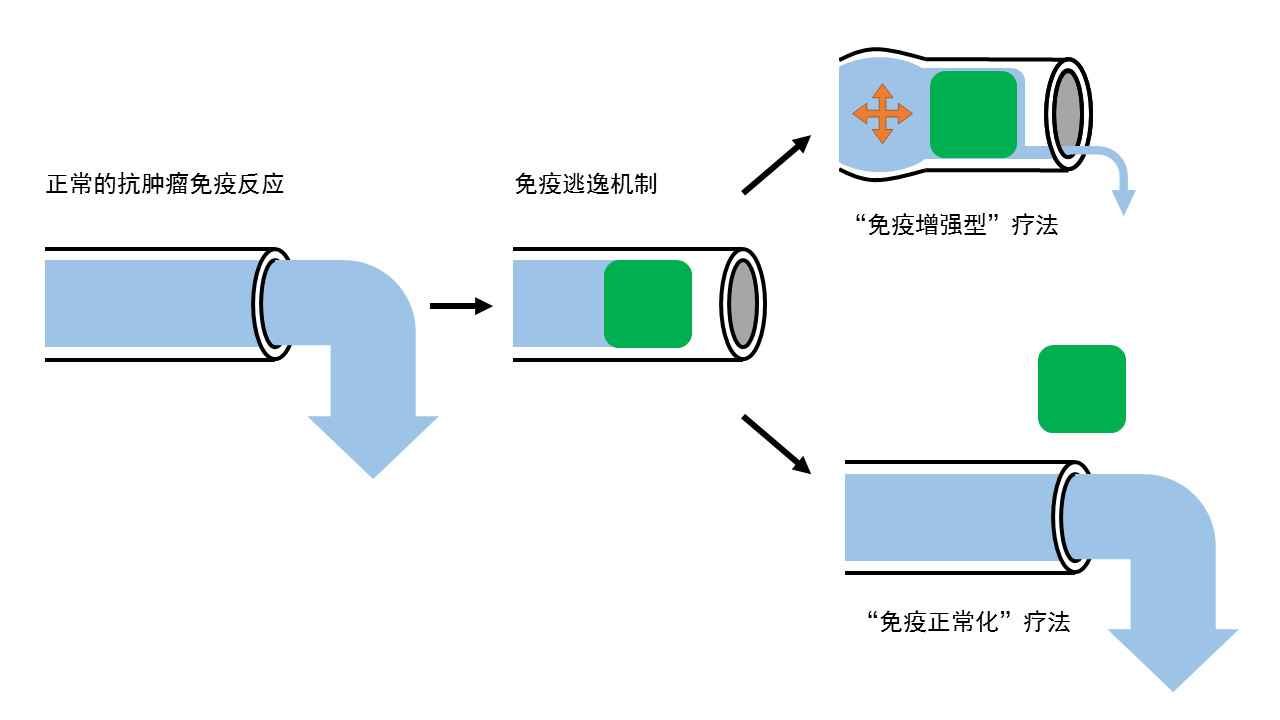
▲“免疫增强型”疗法与“免疫正常化”疗法的示意图(数据来源:参考资料[1];制图:药明康德内容团队)
这些疗法在临床上取得了巨大成功,也催生了大量组合疗法的研发。但免疫疗法领域的这一发展趋势,却有些出乎陈列平教授的预料——“几年前我预计说,肿瘤微环境中还有那么多的靶点没有发现,无论是公司还是投资者,如果能大规模投入其中,把微环境中的问题搞清楚,免疫疗法一定会有大发展。但现在看起来,大的方向有一点偏,不大像我预测的方向。”
陈列平教授分享说,目前研究免疫组合疗法的临床试验在美国已经超过了2000个,其中90%以上都是研究PD-1/PD-L1与其他疗法的组合。“这也可以理解是比较快速的一条路,但把现有的疗法与抗PD-1疗法结合一下,基本上都是随机的组合,没有太多科学依据在里头。”当然,偶尔一些组合疗法能取得较好的治疗效果,今年4月获批的Keytruda与Inlyta组合(靶向PD-1与VEGFR)就是一个例子。“但疗效之外,我们依然学不到多少东西。”
“从历史上看,抗PD-1/PD-L1抗体的治疗效果和其他疗法大不一样,趋势还是挺明显的。很重要的一点是我们已经知道为什么不一样。知道为什么有效,才能学到东西,”陈列平教授说道:“我还是相信要解决最基本的科学问题。大部分肿瘤目前还不能被有效控制。如果不能从组合疗法中学到新东西,我们的进展就不会很快。”
序章的终结
去年10月,陈列平教授团队在顶尖学术期刊《细胞》上发表前瞻性评述(perspective),总结了他对免疫疗法过去数十年来发展的思考。在他看来,我们需要更多让免疫系统“恢复正常”的疗法,这是治疗更多癌症所需的范式改变,也意味着免疫疗法将终结序章,走向成熟。

▲陈列平教授团队在《细胞》上刊文指出,免疫疗法的范式需要改变(图片来源:参考资料[1])
专访中,陈列平教授向药明康德内容团队介绍了研发这些 “免疫正常化”疗法的三个原则——“第一点,我们要知道免疫缺陷是否是肿瘤引起的。而这些机制不是正常免疫系统需要的,因为这样才会给将来肿瘤治疗带来选择性。” 举例来说,CTLA-4并非是肿瘤特异利用,而是整个正常免疫系统都需要的分子。一旦把它去掉,正常免疫系统就会出现异常。“CTLA-4这个靶点用于治疗黑色素瘤有作用,但并没有让我们学到很多新东西,更多的还是以前‘增强免疫’的概念”。
这一点容易理解,研究起来却有一定难度。陈列平教授指出,由于进入新药临床试验的大多是晚期病人,疾病已经存在多年,常常经过了多种不同的治疗,因此癌症或者免疫系统本身,或多或少都有些“人为引起的变异”,病人之间的异质性非常大。因此,一定要对病人群体进行细分,选择性地寻找其中的关键分子。
“第二点,这些免疫缺陷(分子)需要集中在肿瘤微环境中,而在正常组织中完全或几乎没有。”陈列平教授说:“我们需要找到肿瘤特异或是高度选择性表达的分子。这样就算新药治疗中发生不可预测的副作用,它们也集中发生在肿瘤微环境。”
“第三点,新的靶点需要是一个主要的功能通路。这也是更难一些的要求。我们观察到在肿瘤里面,有很多通路可以共存。怎么找到一个能够调节整个微环境的主要通路?”陈列平教授介绍说,他的团队目前开发了一种新的系统,能将病人的肿瘤组织移植到具有免疫缺陷的小鼠身上。这等于是将微环境孤立出来,然后特异性地用药物去做调控,寻找其中的关键通路。这能避免系统性免疫增强干扰对实验结果的影响,也能让研究人员们对药物的评估结果更具信心。
“这三条在我看来,只是最低要求,”陈列平教授说道:“在这个基础之上,针对不同靶点的作用机制,增加新的标准,才能找到最好的靶点。”
寻找新的靶点
根据患者体内PD-L1水平的高低,以及肿瘤浸润淋巴细胞(TIL)的多寡,陈列平教授团队将肿瘤病患分为四类。其中TIL较多的患者群体是研究人员们的侧重点。“这些患者体内的T细胞已经进到肿瘤部位了,目标比较明确。之所以T细胞不起作用,说明微环境里肯定有其他分子,光抑制PD-L1还不够。”陈列平教授解释道。
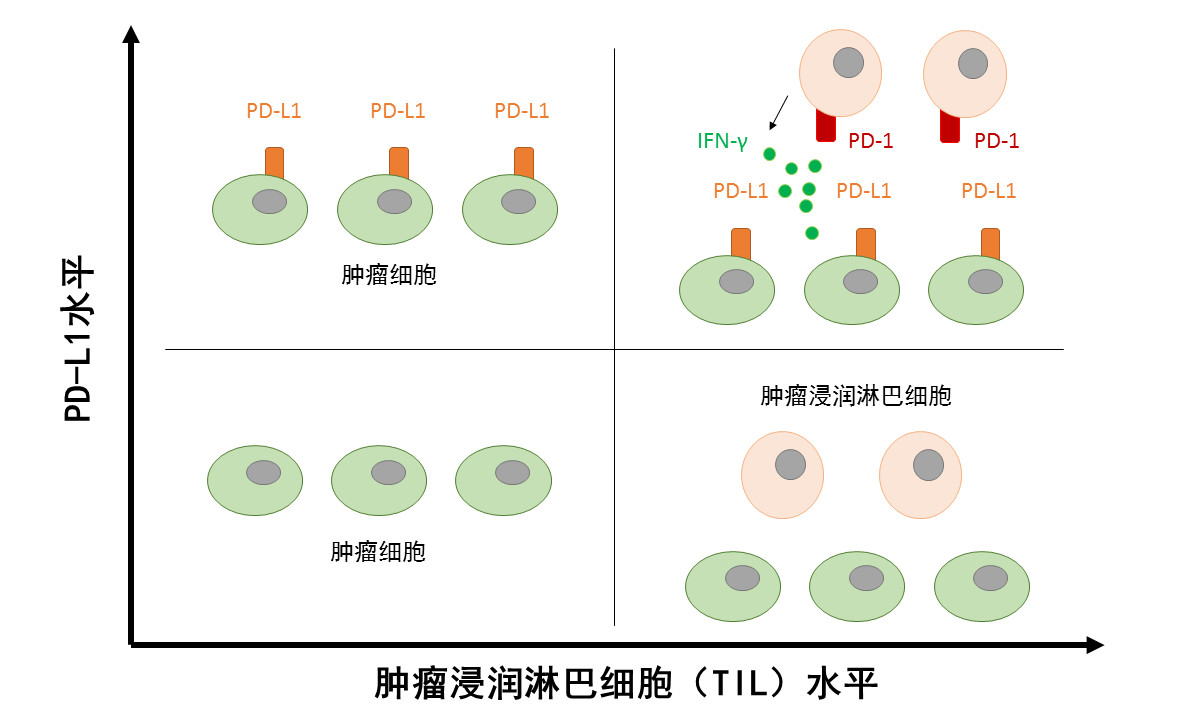
▲TIL较多的患者是研究人员们的侧重点(数据来源:参考资料[1];制图:药明康德内容团队)
为了寻找潜在的免疫疗法新靶点,陈列平教授团队开发了一个筛选平台,其中包含了超过95%的人类膜蛋白。利用这一平台,研究人员们能够找到一些可能影响免疫功能的分子,再回到肿瘤类型中做比对,寻找这些分子在肿瘤中是否有特异性的变化。利用这一平台,这支团队找到了多个潜在的新靶点。今年1月正式发表于《细胞》杂志上的LAG-3配体FGL1,就是最新的一个案例。
找到靶点后,研究人员们思考的,便是如何进行快速的转化,将最新科学发现转变为造福患者的创新疗法。“我们其实找到了很多潜在靶点。在选择靶点进入临床试验前,我们根据常见的实体肿瘤,列了一张表格。根据病理学分析,我们尽量选择涵盖较多肿瘤类型的靶点进入临床,”陈列平教授介绍道:“这样的疗法也能帮到更多的患者。”
NextCure
在临床转化的过程中,曾启动并参与组织抗PD-1/PD-L1抗体首个人体试验的陈列平教授也在不断总结过去的经验与教训。“在做完PD-1/PD-L1通路的研究后,我们也曾检讨和反思,为什么科学研究要等上十多年才上临床,我们能不能做得更好?”
反思找到的问题,是学术界与产业界之间所存在的一道鸿沟。“学术界有这么一个现象,就是研究出一个东西来,需要写成文章,经过同行评议,然后再发表。如果一家公司对你的研究感兴趣,再和学校协商引进专利授权,这个过程可能要3-5年。”陈列平教授说道。

而解决这个问题的答案,则是一家名为NextCure的生物技术公司。“这个名字是我起的,可以看出当时很有信心。当时我们觉得在抗PD-1/PD-L1疗法之后,还能治愈更多的癌症,”陈列平教授笑着说道:“创立NextCure的想法,就是把这几年的时间省下来。”
自建立之初,NextCure团队就与陈列平教授团队保持着紧密联系。每当找到一个潜在靶点,科学家与研发人员就会根据主要数据进行讨论,决定是否要继续推进。“我们当时的想法是,一旦发现潜在靶点和基本原理,就能在发表论文前推进到临床试验。我们可以同时做,不能等到论文发表之后再做。”
NextCure的领先在研疗法NC318(一款“first-in-class”的Siglec-15抑制剂)就在这一模式下,快速推进到了临床阶段。“我们临床试验去年10月开始,当时论文在审稿阶段,还没有发表。到了今年2月论文在线发表时,我们的1期临床已经进行一半了,”陈列平教授和我们分享道:“如果按传统方法,在论文发表后还要再和公司协商转让, 然后验证结果, 生产药物等等。不知道还需要多久。”

▲本研究正式发表时,1期临床试验已经进行过半(图片来源:参考资料[2])
时间上看,从发现靶点起,NextCure就在筹划抗体的生产,以及临床试验的准备。与此同时,研究人员们还在不断完善科学细节,准备论文的发表。“有时这些数据不是临床试验所必需的,却是发表论文所必需的,是锦上添花的工作,但并不影响主要结论。”陈列平教授说道。通过齐头并进,据估计,NC318在临床推进上,省下的时间比传统方法至少要超过3年。
新型免疫疗法的曙光
目前,NC318正在1/2期临床快速推进,预计8月前能结束1期临床试验的阶段,而2期临床设计也接近完成。在剂量爬坡试验中,研究人员们并没有观察到明显毒性,这也符合试验的预期。“如果只是集中于肿瘤部位,调控微环境的‘主要开关’,我们本来也预期它没有多少毒性。证实这一点,让我们感到非常振奋。”陈列平教授说道。由于作用部位高度特异,“低毒性”或许正是“免疫正常化”疗法的一个特性。
根据公开信息,一名先前对PD-1/PD-L1治疗产生耐药的肺癌患者,已在NC318的治疗后出现了部分缓解。考虑到1期试验部分的终点是安全性和耐受性,陈列平教授认为目前的数据表明,这算是一个非常成功的1期临床试验。“要知道这还只是1期临床试验,还在做剂量爬坡。前面的很多剂量还很低,可能不是用于治疗的最佳剂量。但我们不光得到了安全性和耐受性数据,还见到了一些缓解病例。当然,这些还需要在2期临床试验中做验证。”
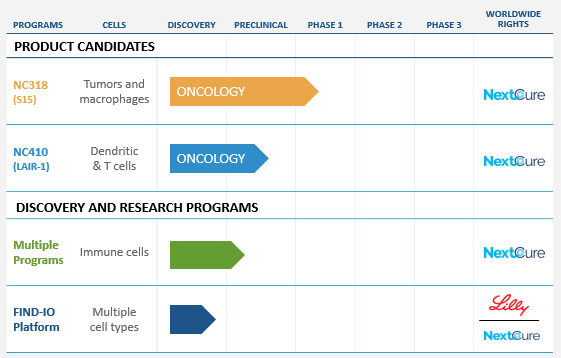
▲NextCure的在研管线一览(图片来源:NextCure官方网站)
值得一提的是,与PD-1/PD-L1通路尽量减少重叠,正是NextCure选择靶点中的优先考量。因此他们在临床试验中所接受的患者,要么是PD-L1表达水平较低,不符合其他临床试验的需求;要么是已经经过了抗PD-1/PD-L1疗法的治疗,疾病却依旧出现进展。这些患者,也正是最需要创新疗法的人群。
不过陈列平教授也指出,癌症免疫疗法并不是万能药。考虑到晚期肿瘤的高度异质性,每一款创新免疫疗法,所能治疗的也只是一部分患者。“目前看,NC318与抗PD-1疗法适用的患者群体可能差不多大。比如黑色素瘤里有20-30%的患者可能生效,肺癌里也差不多。”
5-10年内搞清癌症
聊到对癌症免疫疗法的专注与热情,陈列平教授提到了他最初当医生的经历。“我做过很短一段时间的医生。当时我在肿瘤科,但上个世纪80年代的肿瘤科很惨,连化疗药都只有很少的几种,所以每个病人进病房都很清楚自己必死无疑。我们只是让这些病人多活几个月,而且这几个月生命的代价还很大,因为药物的毒性很大,”陈列平教授回忆说:“我天天看到这样的情况,但什么都做不了,然后看着病人去世,这是一个很难受的工作。”也正因为此,陈列平教授辞去了医生的工作,考到了协和医学院做研究生。而在“预防”与“治疗”两大方向之间,他挑选了离临床转化比较接近,“这辈子还能看到疗法问世”的免疫学。
30多年的耕耘后,这名曾经的肿瘤科医生,已经成为了全球癌症免疫疗法的领军人物。当问及免疫疗法何时能攻克癌症,陈列平教授指出业界不宜操之过急。即便是抗生素这样存在那么久的药物,也只能控制绝大多数的感染。对于癌症治疗,我们同样不能要求100%治愈。
“现在的抗PD-1/PD-L1疗法下,很多患者可以长期得到部分缓解。他们的肿瘤还在,但很稳定,或者正在慢慢缩小,可以活很长时间。如果能达成这个目的也不错,”陈列平教授说道:“晚期肿瘤的异质性太大。如果有像PD-1/PD-L1这样的主要通路,能再找到3到4条,控制或者治好70%-80%的肿瘤,实际上就已经很成功了,这个目标是可以达到的。”
“以这个目标来说,应该不会太久。现在我们已经很清楚肿瘤微环境是一个主要的靶向部位,所以我们至少知道应该去哪里找东西。当然临床试验进展可能比较慢一些,但我觉得未来5-10年里,应该能把这些主要的通路搞清楚,”陈列平教授补充道:“我对此还是很乐观的。当然,实现这一目标前,我们还有大量的工作要做。”
参考资料:
[1] Miguel F. Sanmamed and Lieping Chen, (2018), A Paradigm Shift in Cancer Immunotherapy: From Enhancement to Normalization, Cell, DOI:https://doi.org/10.1016/j.cell.2018.09.035
[2] Jun Wang et al., (2019), Siglec-15 as an immune suppressor and potential target for normalization cancer immunotherapy, Nature Medicine, DOI: https://doi.org/10.1038/s41591-019-0374-x
[3] NextCure官方网站, Retrieved June 25, 2019, from https://www.nextcure.com/
[4] 陈列平教授 – 耶鲁大学官方页面, Retrieved June 25, 2019, from https://medicine.yale.edu/bbs/people/lieping_chen.profile







