本文转载自“BioArt”。
胶质瘤是成年人中最常见的的原发性恶性脑部肿瘤。世界范围内,每年每十万人中就有2-3个新增胶质瘤患者,胶质瘤三年生存率仅为10.1%【1】。原发性胶质瘤的无进展生存期(progression-free survival,PFS)中位时间为6.9个月,常规治疗下中位生存期(median overall survival)为14.6个月。而复发性胶质瘤的中位生存期大概为24-44周【2】。
针对PD-1/PD-L1的检查点阻断疗法对黑色素瘤有很好的疗效。对免疫检查点阻断疗法的应答率较低限制了这种免疫治疗在多种肿瘤治疗中的应用。肿瘤中突变负荷,对新抗原(Neoantigen)的反应和肿瘤中免疫细胞浸润是肿瘤对检查点阻断疗法应答的关键【3】。胶质瘤突变负荷较低,同时肿瘤微环境中缺乏淋巴细胞浸润,是一种“冷”肿瘤(“cold” tumor)【4】。尽管在小鼠模型中,阻断PD-1信号对原位移植的胶质瘤有治疗效果。但在临床试验中,与传统治疗相比抗PD-1抗体并没有带来显著效果【5】。
最近的研究表明在非小细胞肺癌和黑色素瘤中,即使PD-L1表达不高,在常规治疗之前给予病人抗PD-1抗体的免疫治疗,可以改善病理反应,形成有助于免疫治疗的肿瘤微环境【6】。这个结果为“冷”肿瘤的治疗提供了新的思路。
2月11日,Nature Medicine杂志背靠背发表了两组临床试验,报道了抗PD-1抗体作为新辅助疗法(Neoadjuvant treatment)对胶质瘤的治疗效果。来自加州大学洛杉矶分校的Robert Prins 和Timothy Cloughesy领导的团队发表了题为Neoadjuvant anti-PD-1 immunotherapy promotes a survival benefit with intratumoral and systemic immune responses in recurrent glioblastoma的文章,证实抗PD-1抗体pembrolizumab作为新辅助疗法可以提高病人生存,并伴随良好的病理反应。

在该研究中,35名复发性胶质瘤病人中有16名在手术前被实施抗PD-1抗体新辅助治疗,并与剩余19名同样经历术后抗PD-1抗体辅助治疗(Adjuvant treatment)。抗PD-1抗体新辅助治疗组的中位生存期为417天,而未经新辅助治疗的中位生存期为228.5天。新辅助治疗伴随T细胞和干扰素-γ相关基因表达升高,肿瘤细胞周期相关基因下调等表现,而未经新辅助治疗组并无此现象。肿瘤微环境中PD-L1表达上调,T细胞克隆性扩增以及外周血T细胞中PD-1表达降低,单核细胞减少这些都提示新辅助治疗可以增强局部和系统抗肿瘤免疫反应。
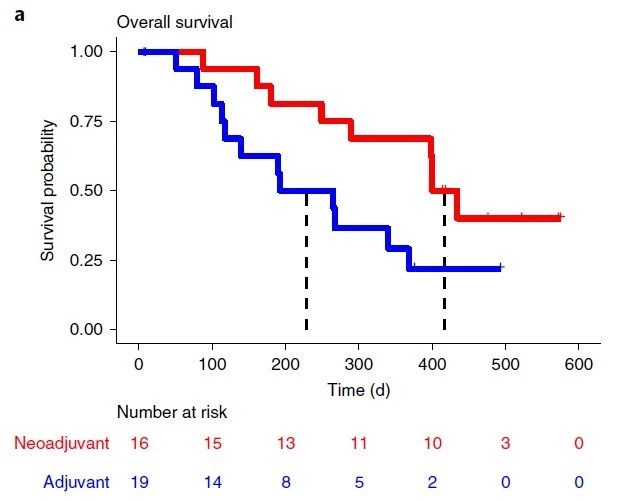
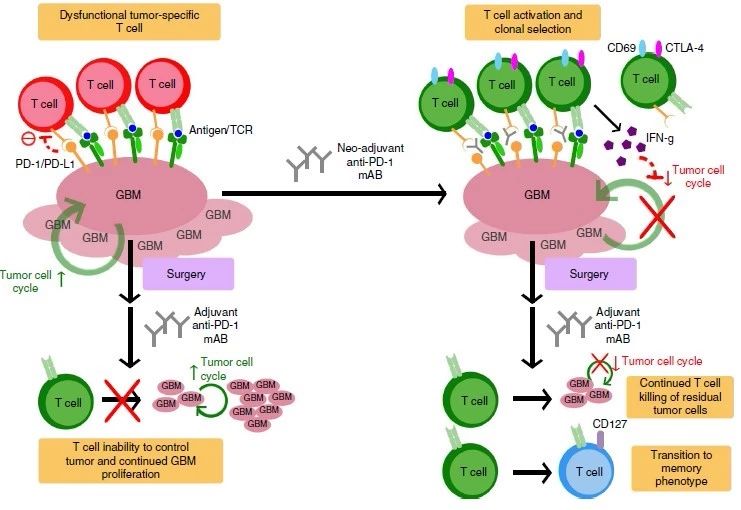
抗PD-1抗体作为新辅助疗法的效果和可能机制
在另一项研究中,来自西班牙Navarra大学的 Ignacio Melero领导团队发表了题为Neoadjuvant nivolumab modifies the tumor immune microenvironment in resectable glioblastoma的文章。在这项研究中,包括3名原发病人和27名复发胶质瘤病人接受了抗PD-1抗体nivolumab作为新辅助疗法,无进展生存期中位时间为4.1个月,中位生存期为7.3个月。作者声称尽管并未带来显著临床效果,但其中有三名病人在长时间的随访中仍生存。新辅助治疗也调控了肿瘤免疫微环境,使细胞因子表达升高,免疫细胞肿瘤浸润增加,肿瘤浸润T细胞克隆性扩增。

这两项研究支持了免疫检查点抑制剂或肿瘤疫苗等其他调控肿瘤微环境的措施作为新辅助疗法的益处,为免疫治疗应用于其他“冷”肿瘤提供了进一步支持。
原文链接:
1、https://www.nature.com/articles/s41591-018-0337-7
2、https://www.nature.com/articles/s41591-019-0349-y
参考文献
1. Ostrom, Q. T., H. Gittleman, P. Liao, T. Vecchione-Koval, Y. Wolinsky, C. Kruchko, et al. 2017. CBTRUS Statistical Report: Primary brain and other central nervous system tumors diagnosed in the United States in 2010-2014. Neuro-oncology 19: v1-v88.
2. Clarke, J. L., M. M. Ennis, W. K. Yung, S. M. Chang, P. Y. Wen, T. F. Cloughesy, et al. 2011. Is surgery at progression a prognostic marker for improved 6-month progression-free survival or overall survival for patients with recurrent glioblastoma? Neuro-oncology 13: 1118-1124.
3. Snyder, A., V. Makarov, T. Merghoub, J. Yuan, J. M. Zaretsky, A. Desrichard, et al. 2014. Genetic basis for clinical response to CTLA-4 blockade in melanoma. The New England journal of medicine 371: 2189-2199.
4. Quail, D. F., and J. A. Joyce. 2017. The Microenvironmental Landscape of Brain Tumors. Cancer cell 31: 326-341.
5. Reardon, D. A. et al. 2017. OS10.3 randomized phase 3 study evaluating the efficacy and safety of nivolumab vs bevacizumab in patients with recurrent glioblastoma: CheckMate 143. Neuro-oncol. 19, iii21 .
6. Forde, P. M., J. E. Chaft, and D. M. Pardoll. 2018. Neoadjuvant PD-1 Blockade in Resectable Lung Cancer. The New England journal of medicine 379: e14.







