当下免疫治疗热,越来越多的企业参与到免疫治疗药物的研发中,截止目前我国已经有4款免疫检查点抑制剂获批治疗癌症。
遗憾的是,大部分人却无法从免疫治疗中获益,或者获益有限。
这个问题存在的原因,一方面是肿瘤可能还存在其他抑制免疫系统的方式,使得免疫治疗药物无法起作用。另一方面还在于肿瘤进化出了耐药机制,使得药物的效果大打折扣,甚至直接失效。
目前,人们对免疫检查点抑制剂的耐药性问题还束手无策。随着免疫治疗的快速普及,这个问题在未来可能会愈发严重。
最近,哈佛大学的W. Nicholas Haining博士率领的研究团队发现,将肿瘤的ADAR1基因敲除后,便能大幅增强肿瘤对免疫治疗药物的敏感性,克服了肿瘤对免疫治疗的耐药性。
这个发现对于克服当前面临的免疫治疗耐药性问题,具有重要的指导意义。这项研究发表在顶级学术期刊《自然》上[1]。

W. Nicholas Haining博士
免疫系统在对肿瘤发起攻击时,首先要对肿瘤进行识别,这需要有肿瘤抗原的存在。肿瘤抗原包括肿瘤在癌变过程中产生的新抗原,以及肿瘤异常表达或过表达的抗原物质。这些抗原可以是蛋白抗原,也可以是肿瘤特异的核酸,包括DNA和RNA。
患者在接受免疫治疗的过程中,往往会出现抗原丢失的现象,使得免疫系统不能对其进行识别,进而无法引发免疫反应。这是肿瘤对免疫治疗产生耐药性的重要原因。
寻找背后的耐药机制,对于让患者从免疫治疗中获益有极大的帮助。
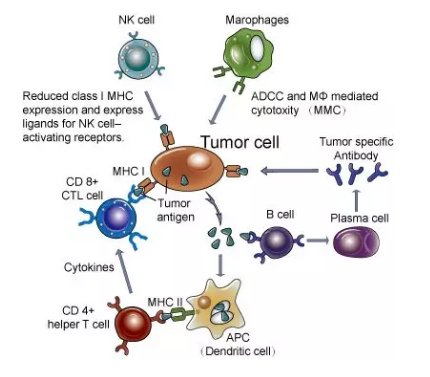
肿瘤免疫反应
2017年, W. Nicholas Haining团队通过CRISPR技术对潜在的免疫治疗新靶点进行了大规模筛选,鉴定出了很多与肿瘤免疫相关的基因,这项研究发表在《自然》上[2]。
在这些基因中,有一个叫ADAR1的基因表现尤为突出。当将肿瘤的ADAR1基因敲除后,耐药的肿瘤便能响应免疫治疗药物了。
其实人们对于ADAR1基因早有研究。
ADAR1基因编码的ADAR1蛋白是一个双链RNA(dsRNA)编辑酶,它能将dsRNA上的腺嘌呤(A)转化为次黄嘌呤(I),而次黄嘌呤又会被“误”认作鸟嘌呤(G)。也就是说,ADAR1蛋白具有改变dsRNA序列的作用。
前面我们提到过,核酸也可以作为抗原,被免疫系统识别,其中就包括dsRNA。
当dsRNA被一些感知蛋白(如PKR、MDA5等)识别后,这些蛋白在IFN的刺激下,会激活大量基因的表达,引发免疫反应。
但是,如果dsRNA的序列被ADAR1蛋白改变,则可能使识别蛋白无法再感知它们,进而就无法激活相关的基因表达了。简单来说,就是ADAR1蛋白会阻断IFN信号通路[3]。
ADAR1蛋白的这种功能其实为了防止正常细胞被免疫细胞攻击,以免发生自身免疫疾病。
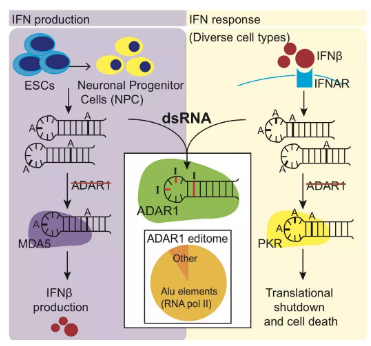
ADAR1蛋白的作用
然而,和PD-1和CTLA4这两个免疫检查点一样,ADAR1蛋白的这种免疫调节功能可能被肿瘤利用。
因为IFN信号通路在肿瘤免疫中也发挥着重要作用。IFN能激活NK细胞的毒活性,激活肿瘤特异性T细胞,诱导T细胞释放穿孔素、颗粒酶等杀伤肿瘤细胞,增强抗原呈递作用等等。
若IFN信号通路被阻断,肿瘤就可能抵抗免疫系统的攻击,使得免疫治疗失效。
事实上,肿瘤并没有放过这个机会。W. Nicholas Haining团队证实ADAR1基因赋予了肿瘤细胞对免疫治疗的耐药性。
他们将ADAR1敲除的肿瘤细胞移植到小鼠体内后,发现肿瘤能很好地响应免疫治疗药物,炎症反应更强,且肿瘤几乎完全消失。与此相反,未敲除ADAR1基因的肿瘤则对免疫治疗没有响应。

ADAR1基因敲除后,再进行免疫治疗,肿瘤几乎被完全消灭
随后,研究人员对浸润肿瘤的免疫细胞进行了单细胞测序,发现在敲除ADAR1基因的肿瘤组织中,几乎所有类型免疫细胞的IFN反应都变强了。
并且,对比ADAR1功能缺陷的肿瘤,ADAR1基因功能正常的肿瘤中发生了大量的dsRNA编辑现象。
此外,在进行免疫治疗后,在ADAR1功能缺陷的肿瘤中,在IFN的刺激下,PKR蛋白(一种dsRNA识别蛋白)下游基因的表达明显提高,而这些基因的表达会抑制肿瘤细胞的生长。同时,MDA5蛋白(识别dsRNA的蛋白)的下游基因也被激活表达,这些基因能引发炎症反应。[4]
这表明,在肿瘤中ADAR1蛋白确实会通过编辑dsRNA阻断免疫细胞的IFN信号通路。而将肿瘤ADAR1基因敲除后,再进行免疫治疗时,IFN信号通路便能被激活,从而抑制肿瘤细胞的生长,并引发炎症反应。

ADAR对干扰素通路的影响
后面,研究者们进一步扩展了这个发现的意义。
他们将ADAR1缺失的肿瘤细胞的β-2-微球蛋白编码基因——B2M基因敲除,使得CD8+T细胞无法识别肿瘤细胞,然后将这种肿瘤移植进小鼠体内。给小鼠注射肿瘤疫苗和PD-1抑制剂。发现在没有CD8+T细胞识别的情况下,肿瘤中干扰素信号非常强烈,而且发生了明显的免疫反应。
这表明,在进行免疫治疗时,CD8+T细胞对肿瘤的识别作用并不是必需的。即使抗原呈递过程缺失,只要肿瘤中的IF信号能引起足够强的炎症反应,就能起到治疗肿瘤的效果。
这对于治疗抗原呈递过程缺失的肿瘤,尤其是那些没有CD8+T细胞浸润的肿瘤,可能具有普遍的意义。
参考资料:
[1] Jeffrey J.ishizuka., ... &W. Nicholas Haining. N. (2018) Loss of ADAR1 in tumoursovercomes resistance to immune checkpoint blockade. Nature, doi.org/10.1038/s41586-018-0768-9
[2] Manguso, R.T., Pope, H., Zimmer, M. D., Brown, F. D., Yates, K., Miller, B. C., ... &Haining, W. N. (2017). In vivo CRISPR screening identifies Ptpn2 as a cancerimmunotherapy target. Nature, 547(7664), 413-418.
[3] Chung, H.,Calis, J. J., Wu, X., Sun, T., Yu, Y., Sarbanes, S. L., ... & Rice, C. M.(2018). Human ADAR1 Prevents Endogenous RNA from Triggering TranslationalShutdown. Cell, 172(4).
[4] Schneider,W.M., Chevillotte, M.D., and Rice, C.M. (2014). Interferon-stimulated genes: Acomplex web of host defenses. Annu. Rev. Immunol. 32, 513–545







