
如今的医药行业正充满自信地跨入一个全新的时代,各种复杂而高端的疗法似乎离最终的上市批准已经触手可及。细胞再生疗法、嵌合抗原受体T细胞免疫疗法(CAR-T)和癌症免疫组合疗法等只是其中的一部分,还有很多其他的领域也正在向前所未有的高度迈进,有望给医疗带来革命性的影响。
在全球主要的生物技术与医药产业中心,人们已经见证了一个又一个爆炸性的科研突破、风云人物和巨额投资,也看到了研发管线内的大量在研新药。近日,《Pharmaceutical Executive》发表了专文,对这些潜力股在2017年进行了前瞻。我们也将用三篇文章来盘点总结当下几个领域内的主要研发管线。
继续前进的CAR-T疗法
Kite Pharma公司如今正为其开发的CAR-T疗法KTE-C19进行四项关键性临床试验。在ZUMA-1试验中,KTE-C19作为弥漫性大B细胞淋巴瘤(DLBCL)的疗法已进入2期临床阶段。今年九月公布的中期分析结果显示,KTE-C19达到了客观反应率的主要临床终点,约为76%,同时完全缓解率也达到了47%。如果FDA认为这些结果已足够证明其有效性,同时KTE-C19的上市申请能于今年末提交,那么最早可能在明年,我们就能看到第一个获批上市的CAR-T疗法。

不过,美国FDA仍然可能希望看到更多的后续试验数据。上述的中期分析结合涵盖了51名患者的数据,而患者招募并未停止,整个试验的目标是对124名患者进行测试,计划于明年三月最终完成。研发者和投资者们希望,这一适应症的强侵袭性和治疗需求的紧迫性能够帮助说服FDA接受这一较为初步的试验结果。
ZUMA系列试验的适应症包括了一系列B细胞肿瘤的亚型。其中,ZUMA-1在今后还会有以滤泡性淋巴瘤(TFL)和原发性纵隔B细胞淋巴瘤(PMBCL)为适应症的KTE-C19试验数据陆续出炉;同样在2期临床的ZUMA-2正在继续招募复发性或难治性套细胞淋巴瘤(MCL)患者;ZUMA-3和ZUMA-4则是正在招募急性淋巴细胞白血病(ALL)的成人和儿童患者。
与此同时,Juno Therapeutics也是在CAR-T疗法领域并行的领军企业。尽管其JCAR015试验疗法在近期遭遇挫折,不过公司表示,同样以CD19为靶点的JCAR017将继续其临床试验。在1期临床试验中,JCAR017在治疗复发性或难治性急性淋巴细胞白血病儿童患者上达到了91%的完全缓解率。一些市场分析人士表示,对JCAR017的前景更加看好。

事实上,Kite和Juno都有着长长的产品链,覆盖了几乎所有类型的血液恶性肿瘤。不仅如此,CAR-T及相关创新疗法未来还可能进入实体瘤治疗领域。Kite的T细胞受体嵌合型T细胞(TCR-T)疗法MAGE A3/A6目前正处于临床2期阶段,适应症就是实体瘤。Juno的TCR-T疗法JTCR016的适应症包括WT1阳性非小细胞肺癌和间皮瘤,也已进入1/2期临床阶段。
试图将细胞免疫疗法用于实体瘤治疗的公司不只Kite和Juno两家。总部位于休斯顿的Bellicum Pharmaceuticals公司目前正在开发独特的GoCAR-T疗法,其代表产品BPX-601将于今年末启动针对胰腺癌的1期临床试验。GoCAR-T有着较好的可控性,其中被改造的治疗性T细胞只有在特定肿瘤抗原和小分子rimiducid同时存在时才会被激活,而rimiducid则是由人为施用于患者的,从而成为了治疗性T细胞免疫活性的一套“开关”。
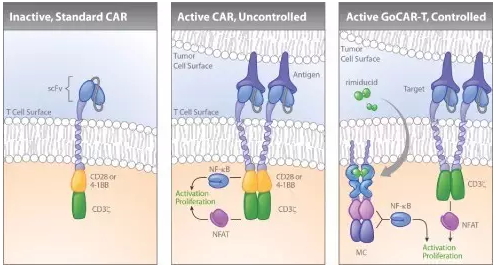
▲GoCAR-T与常见CAR-T比较(图片来源:Bellicum官网)
诺华(Novartis)也加入到了CAR-T疗法的研发队伍中来,其用于治疗急性淋巴细胞白血病的CTL019疗法已进入临床2期阶段,后者的上市申请有望于明年被提交至欧美的监管机构。此外,诺华还表示将扩大其细胞疗法的生产研发设施。
上述在研疗法均需要对源自患者的T细胞进行改造。相比之下,Cellectis正在开发的通用嵌合抗原受体T细胞免疫疗法(UCART)则是与众不同,能够以被改造过的异体细胞用于治疗,无需对患者本人取样。如能成功,这类疗法将成为真正的“现货”(off-the-shelf)产品,可有效地解决规模化和标准化的问题。目前,以CD19为靶标的UCART19疗法已在1期临床阶段,有望用于治疗急性B淋巴细胞白血病(B-ALL)的儿童患者,而辉瑞(Pfizer)和施维雅 (Servier)作为合作方也加入到了这一创新疗法技术的开发中来。
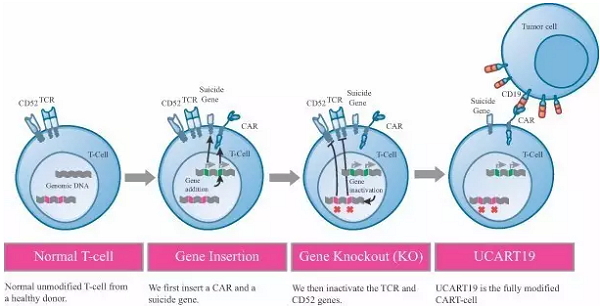
▲UCART19制造过程(图片来源:Cellectis官网)
尽管总是希望找到攻克癌症的简单方法,但是随着像CAR-T这样高度复杂疗法的到来,人们逐渐意识到,面对癌症可能真的没有多少“灵丹妙药”。我们对癌症了解地越深,其分子机制的复杂性则会越多地被呈现出来,而癌症的分类也变得越来越细化。甚至,“癌症”一词的概念也变得模糊起来,我们再也不能用它来“一言以蔽之”了。
肿瘤组合疗法的兴起
如果说CAR-T的到来代表着一种复杂化、高技术难度、个性化的疗法发展趋势,那么“鸡尾酒”疗法的拓展则是体现了组合化这样的另一种前进方向,这尤其存在于癌症免疫疗法的开发中。
癌症免疫疗法的基本思路就是通过某种免疫检查点抑制剂,释放机体的抗肿瘤免疫应答潜能。尽管已经有一些成功临床案例的报道,但是也有很多的患者对单一的疗法并没有反应。为此,人们或许需要进一步了解肿瘤免疫机制的复杂性,从而设计出能够同时破除钳制机体免疫机能充分发挥的多种机制的组合疗法——将多种不同作用机制的癌症免疫疗法同时施用,甚至与化疗、CAR-T等其他类型疗法联用,以将治疗效果最优化。
对于患者来说,根据个人情况量身订制出最合适的组合疗法,不管是从疗效、安全性还是经济的角度来说,都十分重要。因此,临床试验中要求人们能够根据已有的信息,尽量采取最优的组合疗法。

幸运的是,我们现在已经有了第一个被批准的癌症免疫疗法组合——百时美施贵宝(BMS)的Opdivo(nivolumab)加Yervoy(ipilimumab),二者分别是PD-1和CTLA-4两种不同免疫检查点的抑制剂。2015年,美国FDA批准这一组合用于治疗BRAF V600野生型不可切除性或转移性黑色素瘤,之后又在今年1月将其适用人群拓展至BRAF V600突变阳性不可切除性或转移性黑色素瘤患者。
如今,越来越多的公司加入到了癌症免疫疗法研发的行列中来。就以PD-1抑制剂抗癌药来说,除了Opdivo之外,还有默沙东(MSD)的Keytruda和基因泰克(Genentech)的Tecentriq都已被美国FDA批准上市。同时,用于测试患者肿瘤中PD-L1标记的检测方法也受到了越来越多的关注。当然,很多公司也正积极为PD-1抑制剂药物寻找合适的组合疗法。可以很放心地说,我们将会看到上百个临床试验陆续上马,用以测试至少20种PD-1抑制剂抗癌药的疗效。







