现在看来,《科学》杂志的预判的确很正确。基于T细胞的CTLA4抗体、PD-1抗体、PD-L1抗体等免疫检查点抑制剂疗法,和CAR-T、TCR-T等细胞疗法,已经在癌症治疗领域出尽风头。
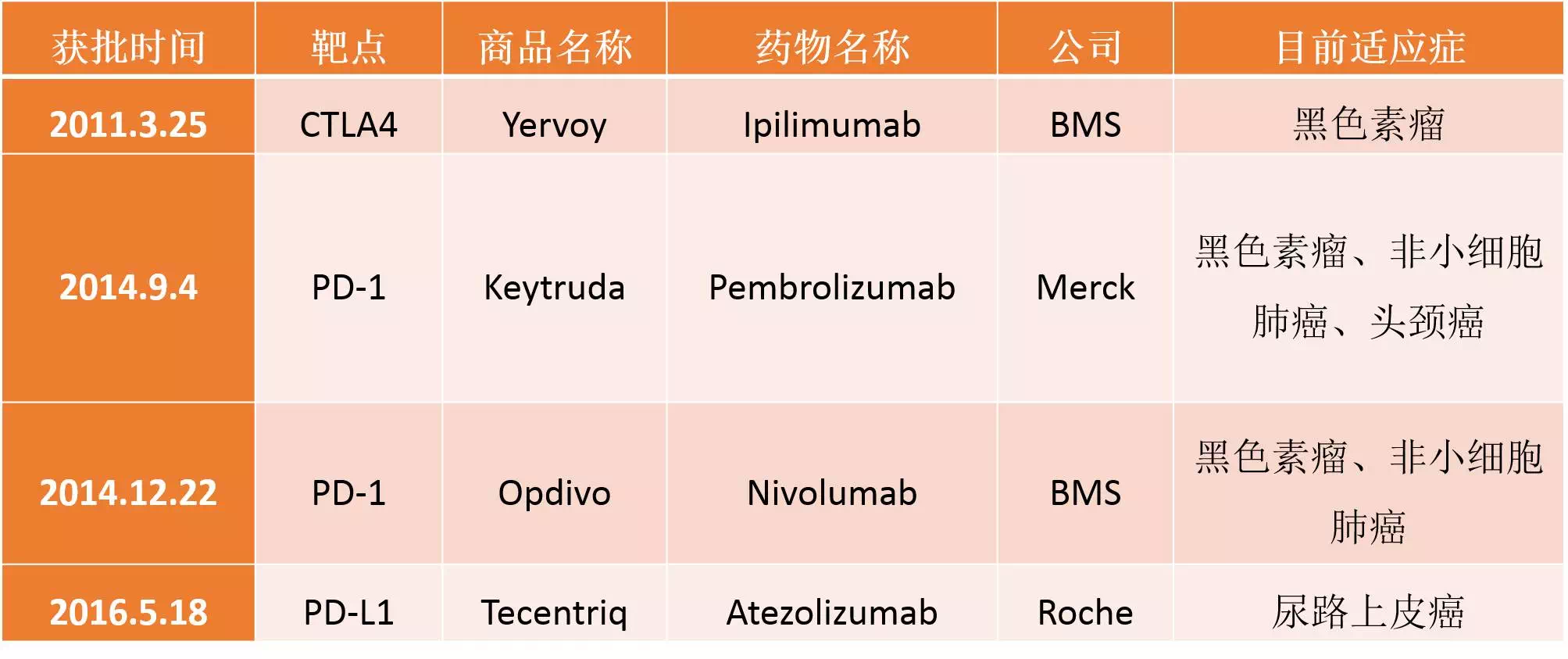
编辑补充:Opdivo获批的适应症还包括晚期肾细胞癌以及经典型霍奇金淋巴瘤【详细】
CAR-T目前还没有获得FDA的上市批准,不过CAR-T细胞免疫治疗近两年已经在临床试验中挽救了很多人的生命,FDA其实对它也是充满期待。前不久,Juno Therapeutics的CAR-T免疫疗法JCAR015临床II试验导致3名患者死亡,FDA临时叫停Juno的试验,仅5天后FDA又允许Juno继续开展临床试验。目前Juno和Kite Pharma正在较劲,如果没有太大的意外,2017年这两家公司中会有一家的CAR-T获FDA上市批准。
虽然基于T细胞的免疫治疗取得了不错的成绩,但是CAR-T在实体瘤上表现乏力,用于治疗实体瘤的PD-1/PD-L1抗体治愈率低,也是医学界不得不面对的事实。
关于这一点,目前业界已经基本达成共识。对肿瘤免疫治疗做出过巨大贡献的陈列平教授也曾表示,肿瘤免疫逃逸的机制不只一种,我们看到的只是冰山一角,还有许多机制仍有待我们发掘。
正因为这个原因,制药巨头一直对新的靶点和机制孜孜以求,不过鲜有收获。
近期,巨头和巨额资金突然奔向一个叫CD47的靶点。好像发现大鱼了!!

8月16日,成立于2006年的肿瘤免疫治疗公司Tioma Therapeutics,经历10年的默默无闻,突然获得GSK和Roche等投资的8600万美元A轮。据Tioma透漏,他们将利用这轮融资推进CD47免疫检查点抑制剂的概念验证(proof-of-concept)临床试验。
而在半年前的2月24日,成立于2015年的肿瘤免疫治疗公司Forty Seven获得Google等投资的7500万美元A轮。Forty Seven也是专注于CD47免疫检查点抑制剂(Hu5F9-G4)的研究,Google投资的时候它正在招募I期临床试验(NCT02216409)的志愿者。霸气的是,本次临床试验,Hu5F9-G4的适应症一栏填的居然是「实体瘤」,这跟之前的免疫检查点抑制剂有限的适应症明显不同。

能搞定所有实体瘤的CD47究竟是个啥玩意儿?竟然在验证概念和临床早期阶段就如此吸金。我猜它的背后一定有非常精彩的科研故事。
如果你读文章很细心的话,一定会注意到,我在前面反复提及:当前的肿瘤免疫治疗都是基于T细胞的。实际上真正参与到免疫过程的细胞非常多。T细胞只是其中比较厉害的一种。
在人体内有两个不同的免疫系统,一个是强悍的获得性免疫系统,以「特种兵」T细胞为代表;另一个是温和的先天性免疫系统,「保安」巨噬细胞就是其中的一员。
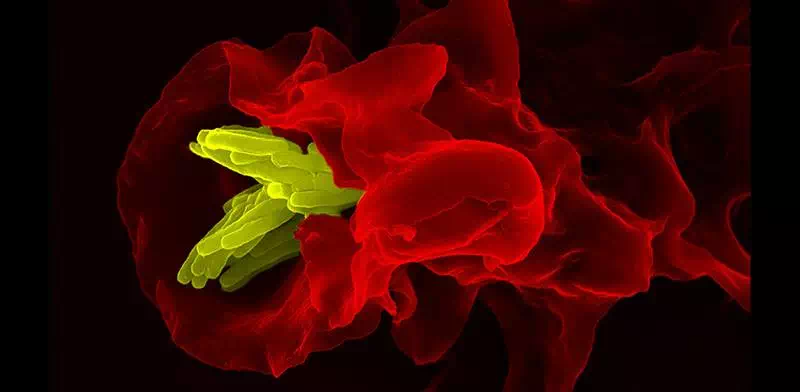
巨噬细胞(红色)吞噬结核杆菌(黄色)(图:德国马普所Volker Brinkmann)
由于基于T细胞的免疫效果强烈,且特异性强,因此,近几年免疫治疗的全面爆发基本上全赖T细胞,无论是CAR-T和TCR-T,还是CTLA4抗体,PD-1抗体,PD-L1抗体。相比之下,只有很少的科学家尝试利用温和的巨噬细胞治疗肿瘤,尽管它在抵抗疾病中也起到了很大的作用。
当然,这也不能全怪科学家,实际上巨噬细胞自身也有一定的责任。
很早以前,研究巨噬细胞的科学家就发现一个奇怪的现象:作为人体健康卫士的巨噬细胞,它与肿瘤的关系似乎很暧昧。正常情况下,逡巡在人体各处的巨噬细胞的主要任务应该是吞噬对人体有害的细胞;然而,研究人员却发现,肿瘤组织里面的巨噬细胞似乎有些异常:巨噬细胞越多的肿瘤,预后越差(2)。这就奇怪了。
通过大量的研究后,科学家有了个惊人的发现:巨噬细胞不仅阻止T细胞等攻击肿瘤细胞,还亲自分泌生长因子滋养肿瘤细胞,促进肿瘤血管的生成,导致癌细胞转移扩散(3)。尼玛!这演的是哪出?!
估计就是因为这个原因,科学家才不愿让巨噬细胞去打头阵。
然而,斯坦福大学的Irving L. Weissman教授和华盛顿大学的William A. Frazier教授等一批科学家则认为:这里面可能另有隐情。经过他们长达数十年的研究,他们揭开了巨噬细胞「叛变」秘密的一角,有一些惊人的发现,而这些发现极有可能补足基于T细胞免疫治疗的不足,掀起免疫治疗的新一轮高潮。而2016年,就是这一轮高潮的开端,而且这个开端还有点儿猛。

华盛顿大学William A. Frazier教授
早在1990年,Hattie Gresham团队偶然在细胞膜上发现了一个整合素相关蛋白(IAP)(4),这个IAP就是今天的主角CD47。1996年,Frazier教授发现CD47的第一个配体凝血酶敏感蛋白-1(thrombospondin-1,TSP1)(5),这个配体是干啥的呢?它居然就跟细胞的增殖,生长和分化有关。在接下来的20年里,Frazier教授围绕TSP1和CD47做了大量的研究。2006年,基于他实验室的研究工作,他联合几个科学家成立了Tioma Therapeutics,就是前几天获得惊人A轮融资的那家公司。
再到1999年,Weissman教授发现了CD47的第二个配体SIRPα(6),而这个配体恰恰与免疫信号的传导有关。十年之后的2009年,Weissman教授再接再厉,在同一期《细胞》上刊登两篇文章(7; 8),详细的阐述了分布在细胞表面的CD47的作用。原来CD47就是用来预防细胞被巨噬细胞吞噬的。简单地说,只要细胞表面出现CD47,巨噬细胞就会把它当做自己人,免疫过程就被阻断了。

斯坦福大学的Irving L. Weissman教授
到这里心中的疑问似乎逐渐清晰了起来,如果肿瘤细胞表面分布着CD47的话,那携带TSP1和SIRPα两个受体的巨噬细胞会收到啥信号?CD47和SIRPα一配对,巨噬细胞就是好朋友了;CD47和TSP1一配对,巨噬细胞就会不自主的促进肿瘤的生长。Bingo!巨噬细胞的确被误解了,是肿瘤细胞太狡猾。
但是到此时,还有一个问题没有解决,巨噬细胞是如何吞噬对人体有害细胞的?这个问题又折腾了Weissman教授6年。2015年,Weissman教授终于揭示了巨噬细胞吞噬肿瘤细胞的机制(9)。

巨噬细胞(紫色)正在吞噬癌细胞(橙黄色)
原来在肿瘤细胞的生长过程中,它们的表面会形成一些特异性物质(如钙网蛋白),就是这些物质暴露了肿瘤细胞的身份。科学家给这些特异性物质取了个形象的名字,叫「吃我」,意思就是「巨噬细胞,你来呀,来吃我呀」(10)。
为了与上面的那个特异性物质相对应,科学家又给CD47取了一个遥相呼应的名字,叫「别吃我」,意思就是「巨噬细胞,你奏凯,我不好吃」(10)。
实际上,CD47是细胞进化出的一种自我保护机制,为了避免被巨噬细胞吞掉,CD47广泛分布于人体各种细胞。
对于肿瘤细胞而言,如果它的表面出现了CD47,巨噬细胞就不会去动它,即使这个肿瘤细胞同时冲巨噬细胞喊「巨噬细胞,你来呀,来吃我呀」。
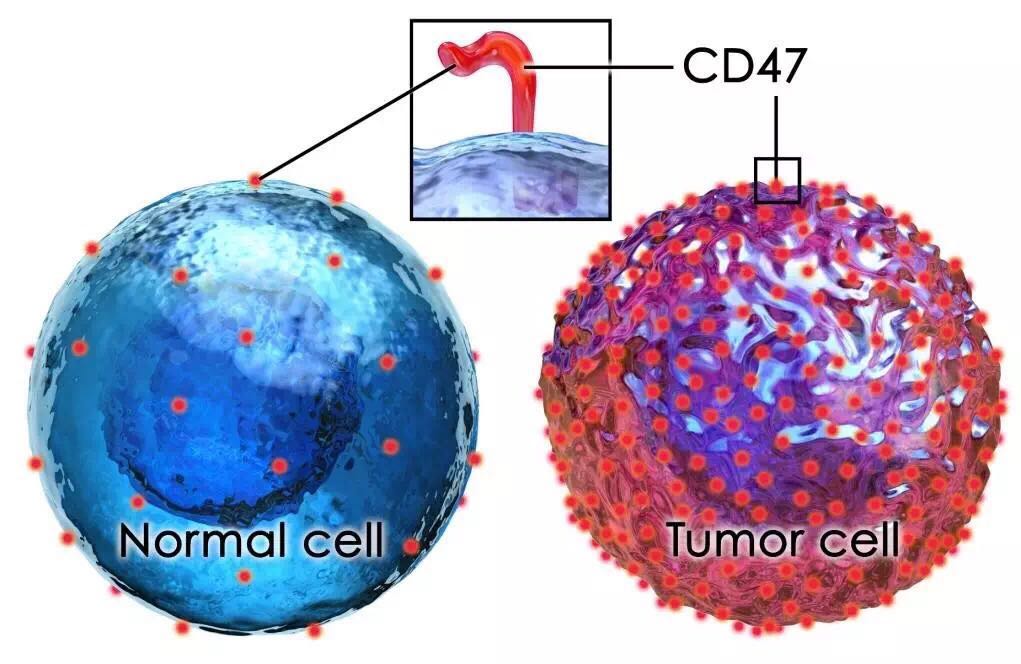
肿瘤细胞为了保护自己,在表面布置了比正常细胞更多的CD47(docplayer.net)
解析了巨噬细胞吞噬肿瘤细胞的机制之后,很容易就可以看出,如果能堵住CD47的「嘴」,肿瘤细胞就在劫难逃了。要知道在肿瘤组织中,逡巡着很多巨噬细胞,据统计,巨噬细胞可以占到肿块总重量的50%左右(11)。
于是,针对CD47的抗体药物就出现了。也许你会觉得这种直接堵上所有CD47「嘴」的做法会伤及无辜,幸运的是,大部分正常细胞都不会去「调戏」巨噬细胞,只有肿瘤细胞才会「得意忘形」地喊「巨噬细胞,你来呀,来吃我呀」。所以CD47抗体对人体的伤害是极小的(10)。
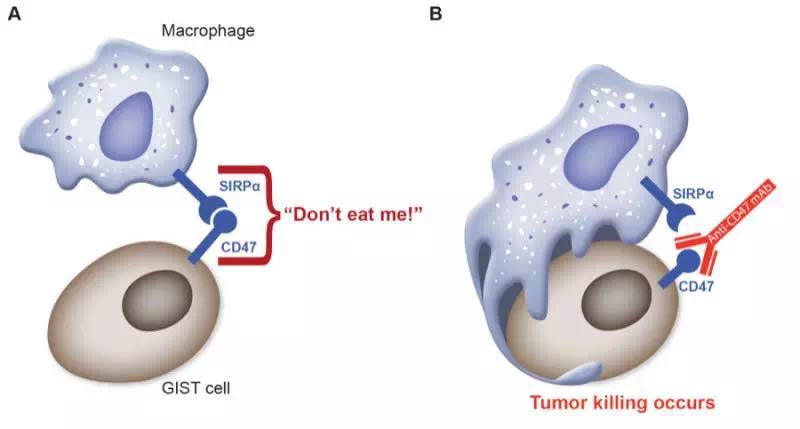
(A)CD47与SIRPα结合,巨噬细胞不吞噬肿瘤细胞;(B)CD47被抗体结合,肿瘤细胞被吞噬(liferaftgroup.org)
在积累了大量的研究成果之后,Weissman教授立即联合另外三名科学家创办了Forty Seven(这个名字应该是直接来源于CD47),并将实验室的100多项专利全部授权给Forty Seven,其中就包括CD47的免疫检查点抑制剂Hu5F9-G4。
目前在全球范围内主要有4家公司在研发针对CD47的药物,除了Tioma Therapeutics和Forty Seven之外,还有Celgene和Trillium Therapeutics。
Celgene的CD47抗体CC-90002是2012年从Inhibrx获取授权,2015年CC-90002开启了两个I期临床试验实体瘤和血癌患者的招募工作。Trillium Therapeutics的CD47抗体是今年1月27日,以3200万美元的价格从Fluorinov Pharma买的。就在8月17日,Trillium也宣布,它的CD47抗体TTI-621也获得FDA的临床试验批准,即将开展实体瘤的I期临床试验。
Celgene的临床前动物实验表明,CD47抗体CC-90002几乎对所有的肿瘤类型都有效果。不仅如此,在使用CD47抗体药物之后,巨噬细胞会吞噬大量的肿瘤细胞,此时释放到环境中的肿瘤特异性抗体又会激活T细胞(12),所以这是一个正向的免疫调节机制。
更让人感到意外和惊喜的是,上个月,Weissman团队在《自然》杂志撰文称(13),CD47抗体还可以用于治疗心脏病。心脑血管疾病和癌症是目前人类最大的两个死因,没想到居然要同时被CD47抗体拿下了。真是一箭双雕。再回过头来看Google、BMS和Roche等的投资,真心觉得值了。
癌症免疫治疗的另一波高潮要来了!
参考资料:
【1】Couzin-Frankel J. 2013. Cancer Immunotherapy. Science 342:1432-3
【2】Steidl C, Lee T, Shah SP, Farinha P, Han G, et al. 2010. Tumor-Associated Macrophages and Survival in Classic Hodgkin's Lymphoma. New England Journal of Medicine 362:875-85
【3】Biswas SK, Mantovani A. 2010. Macrophage plasticity and interaction with lymphocyte subsets: cancer as a paradigm. Nat Immunol 11:889-96
【4】Brown E, Hooper L, Ho T, Gresham H. 1990. Integrin-associated protein: a 50-kD plasma membrane antigen physically and functionally associated with integrins. The Journal of Cell Biology 111:2785-94
【5】Gao A-G, Lindberg FP, Finn MB, Blystone SD, Brown EJ, Frazier WA. 1996. Integrin-associated Protein Is a Receptor for the C-terminal Domain of Thrombospondin. Journal of Biological Chemistry 271:21-4
【6】Jiang P, Lagenaur CF, Narayanan V. 1999. Integrin-associated Protein Is a Ligand for the P84 Neural Adhesion Molecule. Journal of Biological Chemistry 274:559-62
【7】Jaiswal S, Jamieson CHM, Pang WW, Park CY, Chao MP, et al. 2009. CD47 Is Upregulated on Circulating Hematopoietic Stem Cells and Leukemia Cells to Avoid Phagocytosis. Cell 138:271-85
【8】Majeti R, Chao MP, Alizadeh AA, Pang WW, Jaiswal S, et al. 2009. CD47 Is an Adverse Prognostic Factor and Therapeutic Antibody Target on Human Acute Myeloid Leukemia Stem Cells. Cell 138:286-99
【9】Feng M, Chen JY, Weissman-Tsukamoto R, Volkmer J-P, Ho PY, et al. 2015. Macrophages eat cancer cells using their own calreticulin as a guide: Roles of TLR and Btk. Proceedings of the National Academy of Sciences 112:2145-50
【10】Vonderheide RH. 2015. CD47 blockade as another immune checkpoint therapy for cancer. Nat Med 21:1122-3
【11】Morrison C. 2016. Immuno-oncologists eye up macrophage targets. Nat Rev Drug Discov 15:373-4
【12】Tseng D, Volkmer J-P, Willingham SB, Contreras-Trujillo H, Fathman JW, et al. 2013. Anti-CD47 antibody-mediated phagocytosis of cancer by macrophages primes an effective antitumor T-cell response. Proceedings of the National Academy of Sciences 110:11103-8
【13】Kojima Y, Volkmer J-P, McKenna K, Civelek M, Lusis AJ, et al. 2016. CD47-blocking antibodies restore phagocytosis and prevent atherosclerosis. Nature 536:86-90







