6月16日-17日,首届新药创始人俱乐部年会在苏州隆重举行。会上,解放军总医院免疫学研究室/生物治疗病区王瑶副教授(代替韩为东教授)发表了题为“免疫细胞‘成药’探讨”的演讲,回顾了CAR-T的发展历史,汇总了目前的研究现状,探讨了在实体瘤治疗中的限制性和解决方案,以及产业化将面临的挑战。
CAR-T“艰辛”发展与“骤然”突破
过继免疫细胞治疗(Adoptive Cell Transfer,ACT)是指向肿瘤患者体内输入具有抗肿瘤活性的免疫细胞,直接杀伤肿瘤,从而达到治疗肿瘤的目的。自2012年CAR-T在NEJM上发表以来,这一疗法引起了整个世界的轰动。事实上,CAR-T这一概念早在1993年就被以色列科学家Zelig Eshhar提出,遗憾的是,由于当时使用的是一代CAR,缺乏共刺激分子和激活机制,且选择的病例是实体瘤,因此临床效果并不突出。
此后,很长一段时间内,再没有相关的报道。直到2011年,美国宾夕法尼亚大学Carl H. June教授团队针对CD19的CAR-T疗法在1例CLL患者治疗中获得突破;更重要的是,2012年CAR-T治疗ALL患者(现在的“明星小女孩”Emily)再次取得突破,达到完全缓解。随后,这一疗法再次受到全球瞩目,回到世界舞台。
全球正在进行的CAR-T临床试验有173项
CAR-T实际上是一个简单的结构,是将抗体技术与细胞技术的完美融合,不但能够杀伤肿瘤,还能够进行扩增,同时能够在体内长期存活,形成记忆,具有长效性。这一技术几乎弥补了所有ACT的不足,使肿瘤有可能达到真正意义上的治愈。2013年,CAR-T和PD-1被《科学》杂志评为全球十大突破之首,也推动了美国国内多个I/II临床试验。
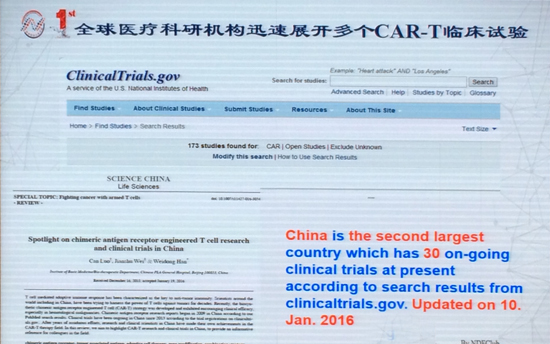
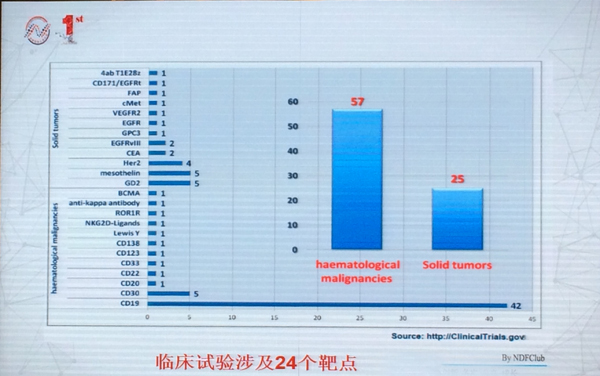
据介绍,截止报告日(6月17日)前一天,全球正在进行的CAR-T临床试验有173项。中国仅次于美国,开展的CAR-T临床试验数量位居全球第二,共计30项,涉及24个靶点。
解放军总医院免疫学研究室自2012年开始注册CAR-T临床试验研究,是亚洲首个开展CAR-T临床研究的机构。截止报告期,已完成147例I/II临床试验,涉及5个血液学肿瘤的靶点以及4个实体瘤靶点。
CAR-T治疗实体瘤的瓶颈
近几年,包括辉瑞、安进、新基、诺华在内的各大制药巨头纷纷进入CAR-T领域,这主要是基于CAR-T在治疗血液恶性肿瘤中展现出了突出的效果。但不可忽视的是,CAR-T在治疗实体瘤方面存在很大的挑战。
NCI的Steven Rosenberg博士曾说:“I don’t think that CARs are going to have much value beyond the hematologic malignancies with very few exceptions.” 报告称,要想真正克服这一瓶颈,可从靶点、到达肿瘤部位的途径、持久性、有效性以及安全性等方面作为突破口。
CAR-T究竟能否成药?
目前,新型辅助CAR-T疗法已经不是一种单一的治疗,而是可以联合放疗 、免疫检查点阻断疗法等技术,这些都有望形成新的突破。但是,CAR-T究竟能否真正成药呢? 这其实需要考虑多方面的因素,如细胞“均一化”问题要不要解决,比如建立细胞库、设计通用CAR-T;化学药物与细胞药物的监管审核标准要不要区分等。
上图中的漫画形象的诠释了CAR在实验室中和临床上的区别。相比在实验室中设计和研究的各种复杂的概念CAR,真正能够产业化的CAR-T细胞必定是一个简单、安全、有效的设计。当然,真正实现这一点还有很多问题需要解决。
据介绍,从CAR-T细胞的制备到回输到患者体内需要2周左右的时间,这其中涉及很多的步骤,容易形成差异和不确定性。目前,CAR-T疗法更多的还是集中在基础研究和I/II临床试验研究。需要强调的是,目前国家的政策是要求“自体免疫细胞治疗技术按照临床研究的相关规定执行”。
推荐阅读