
肿瘤免疫(Immuno-oncology,I/O)正在改变着我们治疗肿瘤的方式。随着精准医疗走向前台,临床研究人员开始用靶向治疗的方法对抗肿瘤,并专注于之前耐药的肿瘤。在一小部分的肿瘤亚组中,通过使用化学药物完成了这个目标;然而免疫治疗是尝试通过驯服我们自身的免疫系统作用机制来靶向肿瘤和肿瘤的通路。
原文作者:Beth Kiernan
尽管是一个相对比较新的途径,但是I/O拥有研究者对可能性的渴望,单克隆抗体、检查点抑制剂(checkpoint inhibitors)、治疗性肿瘤疫苗、细胞因子,以及其他种类的免疫治疗候选药物,以快速的步伐填充到生物治疗公司的研发产品线中。而作为未知领域,肿瘤免疫即伴随着风险,也预示着与之相对等的收益。研究人员在努力鉴别出可以预测药效的生物标志物,注册机构也在努力跟上I/O的发展趋势。
CortellisTM Clinical Trials Intelligence数据库中收录超过2500个活跃的、与商业相关的I/O临床试验(占目前肿瘤临床试验数量的1/3以上)。从该数据我们可以发现33%的临床试验包括两类创新的免疫治疗:治疗性肿瘤疫苗和免疫检查点抑制剂(图1)。虽然过去的5年里,治疗性肿瘤疫苗的试验数量稳步的下滑,尤其是非营利性领域;但是与2010年相比,2015年新开的与商业相关的检查点抑制剂试验数量增长了20倍。
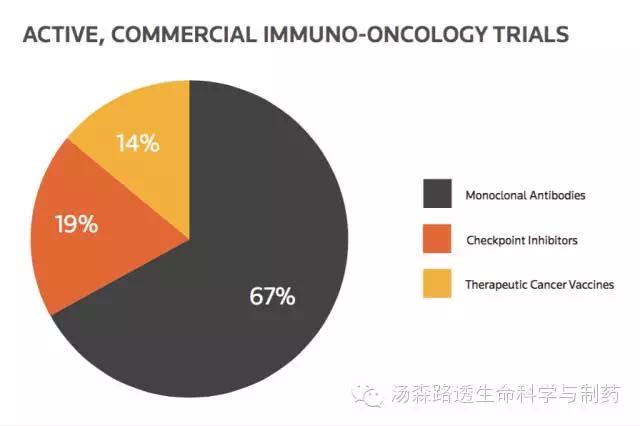
图1 活跃的与商业相关的肿瘤免疫试验比例与分类
在过去的几十年里,治疗性疫苗候选项目一直处于临床研究中,但是研究并不总是能够获益的。通过疫苗诱发针对恶性肿瘤细胞的免疫反应,经常因为免疫系统自身的复杂性而受到阻碍;这种复杂性可能不会显现出来,直到进入患者临床试验。肿瘤细胞也有各种机制以保持避免被T细胞所识别,这又为临床前开发的增加了一层难度。虽然现在有三种肿瘤预防性疫苗被FDA批准,但是到目前为止只有Dendreon公司的Provenge (sipuleucel-T)一种肿瘤治疗性疫苗被批准,该疫苗用于前列腺癌。但是临床研究人员在研发新的方法去克服之前的障碍。继Provenge的成功之后,研发人员在采用各种不同的疫苗策略和方式进行临床开发。
目前有374个活跃的商业化的治疗性肿瘤疫苗的临床试验。平均每个发起人有1.85个试验,很显然,疫苗开发需要相关费用。但是小型到中型的专业生物技术公司和研究机构正在承担相关风险。(图2)
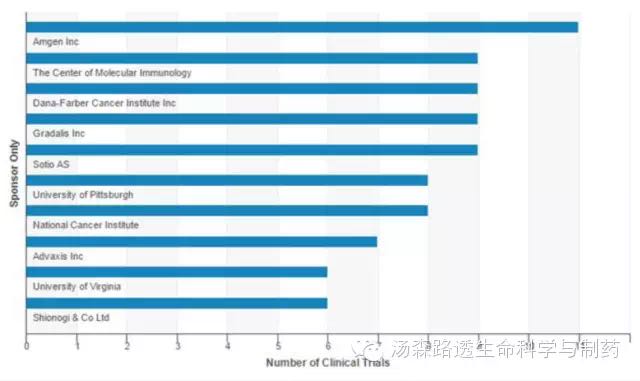
图2 活跃的与商业相关的治疗性肿瘤疫苗的试验发起者前10名
大多数肿瘤治疗性疫苗的试验还在早期发现阶段,这说明着生物制药公司保持着开发的兴趣,同时大约10%的试验成功的进入了后期的试验阶段。(图3)
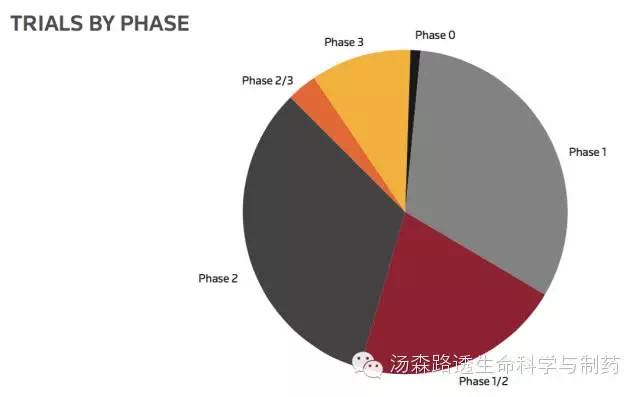
图3 活跃的与商业相关的治疗性肿瘤疫苗试验数量与临床进展(未统计上市后研究或者未报到临床进展试验)
虽然2010年Provenge的上市,取得了人们期待已久的治疗性疫苗的成功,但是研究人员还是面临了试验设计的诸多限制。面对患者选择的时候尤其如此。由于疫苗是免疫治疗的激活剂,所以需要健康的免疫系统来发挥作用。但是之前经历过化疗和其他治疗的患者,由于系统抑制,经常缺乏产生强烈的免疫反应的能力。再加上肿瘤细胞自身固有的抑制免疫系统,保持他们生存的机制。那么研究人员如何绕过这个问题?佐剂和运载工具被用来激活和控制针对抗原的免疫反应。但是将他们悄悄引入系统可能是微妙的。在一项研究案例中,测试了注射gp100黑色素瘤多肽的小鼠反应,采用流行的油包水的乳剂制备方法的疫苗,与设计的作用相反,T细胞直接作用于注射部位而不是肿瘤部位[1]。
在肿瘤免疫治疗领域,免疫检查点抑制剂获得了很多的关注。一段时间以来,细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4, CTLA-4)被用来靶向免疫治疗,同时两个较新的靶点引发了开发者对免疫治疗更高的热情:程序性死亡受体1 programmed cell death 1 (PD-1)和程序性死亡配体1(programmed cell death 1 ligand 1,PD-L1)。和CTLA-4相似,PD-1也是T细胞表面的一个受体。PD-1与配体PD-L1和PD-L2结合,防止T细胞活化,从而负向调节免疫系统。在特定的肿瘤组织中,这些蛋白表达上调,从而抑制免疫系统对肿瘤细胞的反应。检查点抑制剂可以阻断这个机制,允许免疫系统看到肿瘤细胞并且发起攻击。
大公司和专业生物技术公司活跃在这一领域,Bristol-Myers Squibb一路领先。(图4)在Yervoy (CTLA-4)和Opdivo (PD-1)获得成功之后,BMS在努力获得其他肿瘤适应症许可。作为其I/O的产品线的一部分,BMS也在研究KIR和LAG3抑制剂,lirilumab (anti-KIR) 在一期临床, BMS-986016 (LAG3) 2013年开始了一期临床。Roche公司的产品线由PD-L1和 IDO抑制剂组成(分别为RG-7446和 RG-6078)而AstraZeneca专注于CTLA-4 和PD-1/PD-L1,详见汤森路透的Charlotte Jago在PharmaTimes 的文章2。
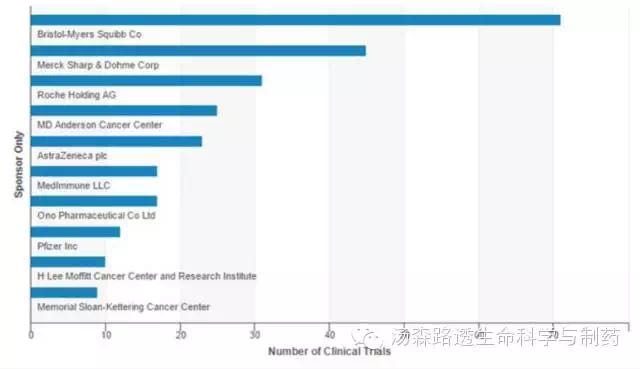
图4 活跃的与商业相关的肿瘤免疫检查点抑制剂试验数量与试验发起人
从482个活跃的与商业相关的检查点抑制剂的试验来看,每个发起人约有3.52个试验,几乎是治疗性肿瘤疫苗的两倍。随着Opdivo 和Merck公司Keytruda取得阳性结果,PD-1的临床试验数量呈上升趋势,约占现有检查点抑制剂试验的52%(图5)。
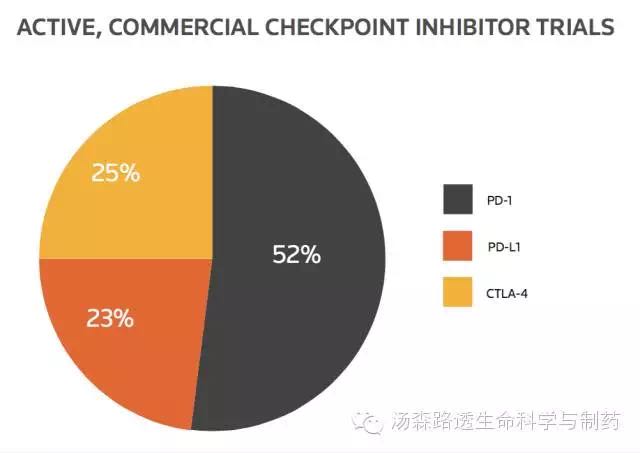
图5 活跃的与商业相关的免疫检查点抑制剂试验数量与作用机制
在PharmaTimes的文章中,Jago展示了与传统治疗方法相比,Yervoy, Opdivo,和 Keytruda的存活率(survival)、总体响应率(overall response rates)都有所增加或者提高。事实上,作者阐述,Merck公司的Keytruda数据是如此的有希望,以至于基于转移性黑色素瘤一期临床的结果,该药就获得了批准2。
检查点抑制剂试验进展事实上从中间分成两个部分,大约52%在早期阶段,48%的在2期和3期,说明生物制药公司既有继续推进兴趣,也有推进到后期成功进展(图6)。
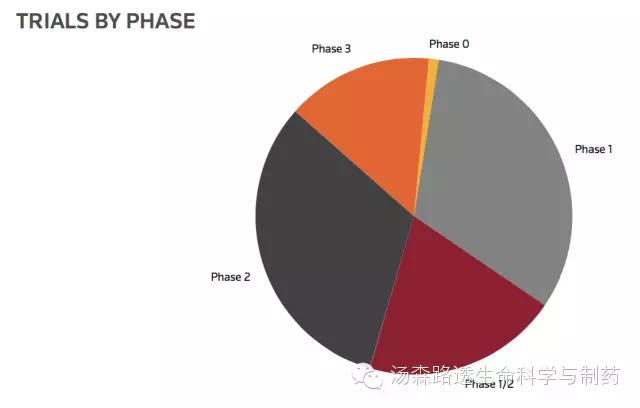
图6 活跃的与商业相关的免疫检查点抑制剂试验数量与临床进展(未统计上市后研究或者未报到临床进展试验)
肺癌超过黑色素瘤成为了检查点抑制剂商业化药物开发最重要的肿瘤类型。从肺癌,黑色素瘤和实体瘤试验中最高的患者分类(top patient segments)来看,在这一领域的开发者已经认准了没有被满足的临床需求-晚期的耐药的肿瘤,这些肿瘤其他药物已经失败(图7)。
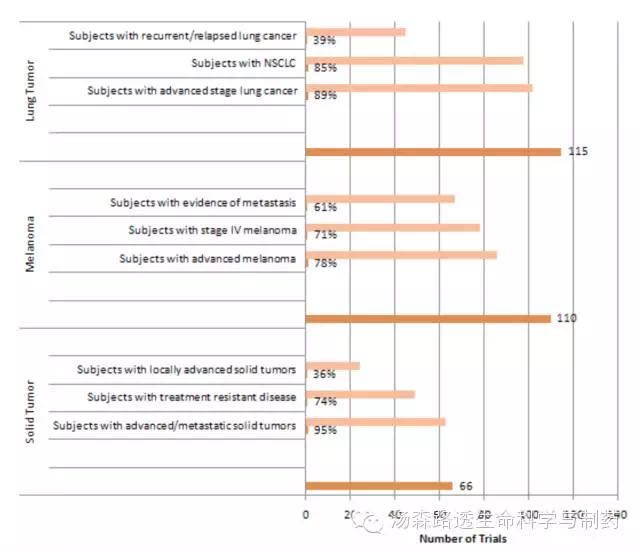
图7活跃的与商业相关的免疫检查点抑制剂试验,最高的三个条件下最常见的患者分类与试验数量
将检查点抑制剂的候选药物推进到临床试验阶段,已知的一个限制条件是预测和预后的生物标志物很难与治疗反应匹配,生物标志物对证明有效性和区分患者人群非常重要。这一点,在采用PD-L1作为生物标记物试验报道中尤其如此(39%的检查点抑制剂的试验使用生物标志物)。虽然PD-L1染色高通常确实与高响应率一致。但是没有染色不一定代表着没有响应率。生理学的生物标志物也相同的相似关系。从现在用于免疫检查试验使用生物标志物来看,每个试验平均有1.23个标志物。在最高的三个条件的检查点抑制剂的研究当中,PD-L1是最常见的生物标志物。在使用生物标记物的肺癌的研究当中,56%的试验测定了PD-L1。表皮生长因子测定占44%,ALK酪氨酸激酶测定占31%(图8)。
在该肿瘤免疫文章中,Jago重点强调的另一个挑战,FDA最近(2010和2013)才发布了指南,用于指导两种未批准候选药物在临床上合用的研究[2]。
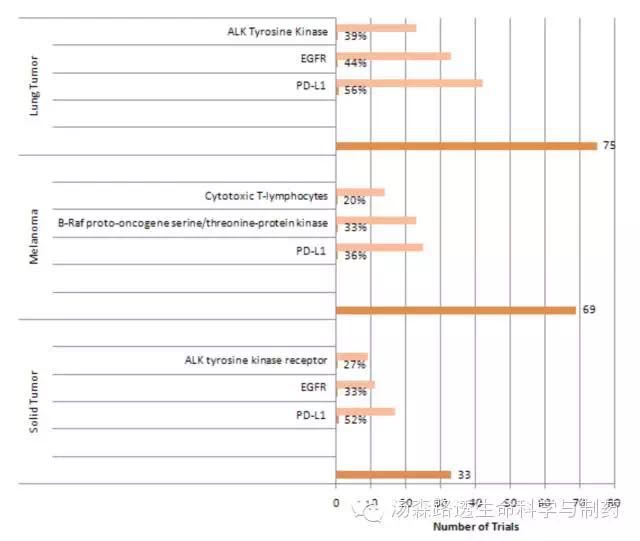
图8 活跃的与商业相关的使用生物标志物的免疫检查点抑制剂试验,在最高三个条件,最常见的生物标志物和试验数量
总结
由于肿瘤免疫治疗吸引着生物制药公司进入,开发新的肿瘤治疗方法,并努力取得阳性结果,因此在这一领域中,发现一块未饱和的区域非常重要。在大公司重金投入检查点抑制剂中,生物技术公司在治疗性肿瘤疫苗领域开拓自己的领地,但下一个是什么?免疫治疗和跨类别的合并用药经证明是成功的。但是I/O是一个快速进展的领域。伴随着安进的黑色素瘤候选药物T-vec (Talimogene laherparepvec)最近取得成功,该药是第一个被批准的溶瘤病毒项目,也许下一个成为一类肿瘤免疫治疗的药物会超越T细胞。当我们继续深入的进入免疫肿瘤领域,药物开发人员智取肿瘤细胞逐渐成为现实。用我们自己的免疫系统,开拓肿瘤治疗方法并不是一个新的途径,但是用更新的方法非常关键,从而能比疾病和竞争对手都领先一步。
参考文献:
[1] Hailemichael, Y. et al. Persistent antigen at vaccination sites induces tumor-specific CD8(+) T cell sequestration, dysfunction and deletion. Nat. Med. 19, 465–472 (2013). https://www.nature.com/nm/journal/v19/n4/full/nm.3105.html?WT.ec_id=NM-201304
[2] Jago, Charlotte. The Immuno-Oncology Paradigm. PharmaTimes (2015). https://edition.pagesuite-professional.co.uk//launch.aspx?eid=cd1122ab-5b80-428d-a3de-078a009af9c4
汤森路透对本文的全部内容以及可能附带的全部资料拥有全部知识产权,并受法律保护。网络转载、编译及其他商业使用请联系:yili1@thomsonreuters.com.







