目前肿瘤检测和治疗在临床上还是以影像学和病理学作为标准和基础,而现在我们已经开始这个基础上做二代测序,提供精准医疗的医学解读来指导患者的靶向用药和免疫治疗。在2015年Astro会议上美国学界预测,十年内90%以上的实体瘤将得到治愈。

△周向军 恒瑞源正(上海)生物技术有限公司
及恒瑞源正(深圳)生物技术有限公司首席科学家、常务副总经理
以下是演讲正文:
上午大家都听了姜文奇主任讲的肿瘤治疗,其中很重要是免疫治疗的进展,上午阎海教授也讲了精准医疗进展尤其在肿瘤治疗上的应用,那我在这个基础上从产品和临床的角度向各位报告一下肿瘤的精准免疫治疗在临床上的情况。
肿瘤治疗领域的现实情况
传统的靶向治疗和近十年风靡的化疗对肿瘤治疗的五年生存率是一样的,平均都是15%左右。但是自从2011年FDA批准了第一个肿瘤免疫治疗的产品CTLA-4抗体上市之后,应用CTLA-4的患者接近5000个,接近十年研究的临床结果发现肿瘤免疫治疗CTLA-4单抗十年的生存率可以达到20%左右,而传统的治疗十年生存是在5%以下。
换而言之,在肿瘤治疗领域里面,免疫治疗就是可以改变五年生存率、实现长达十年的生存率的这么一个治疗手段,而十年我们就认为是治愈了。
肿瘤靶向治疗
去年AACR会议上说明白了,为什么所有肿瘤靶向治疗都会有耐药,因为肿瘤细胞有高度的异质性,肿瘤细胞有高达一个亿以上的遗传变异,所以任何一个单一靶向的治疗药物子啊肿瘤组里已经有耐药、突变的细胞存在了,所以靶向治疗一般三个月有复发,靶向治疗最终都会耐药。

传统的治疗包括化疗,五年生存率10%到15%之间,就像刚才展示的以CTLA-4抗体、PD-1抗体,或者是CAR-T为代表的以T细胞作为单一手段的免疫治疗,它们平均的生存率在20%左右。
当然靶向治疗有一个优势,相比化疗它可以延长中位生存期,但是它不能改变五年生存率。
肿瘤精准免疫治疗
所以第一,目前在治疗临床上,从精准治疗角度上来讲,我们能不能给靶向治疗一个精确的指导,上午阎海教授也讲了很多这方面的进展我就不展开了。
第二,对刚刚上市一两年的免疫治疗包括PD-1抗体,它面对不同的肿瘤也只有20%的响应率,第一个问题是我们能不能把这些响应病原通过其他手段找出来,也就是精准的免疫治疗;第二个问题是对另外80%的病原我们有没有一些治疗手段可以联合起来把响应率从20%提高到60%、70%、80%,破译更多的肿瘤病原,事实上这个两个结论都是正面的。
所以在2015年美国放射肿瘤学会年会(Astro)会议上美国学界已经有这样一个预见:在十年内90%以上的实体瘤是可以治愈的。
国内外精准医疗产品差异

那肿瘤精准免疫治疗从产品研发的角度看,测什么样的基因和产品?测序结果怎么解读?解读后有什么手段可以跟上?这是美国一个公司的报告,这个报告在首页明确提出来避免哪些治疗,临床获益有哪些药品、临床耐受有哪些药品它直接给出了医学解读。

欧盟的一个公司,经过肿瘤样本的测序以后,提出了一些医学解读,绿色是临床获益,红色是临床耐药的。

国内企业,北京一家公司仅仅只给一个生物学解读。不同公司测完之后会告诉你哪个基因突变,FDA评了什么药可以治疗,这只是一个生物学解读行为。
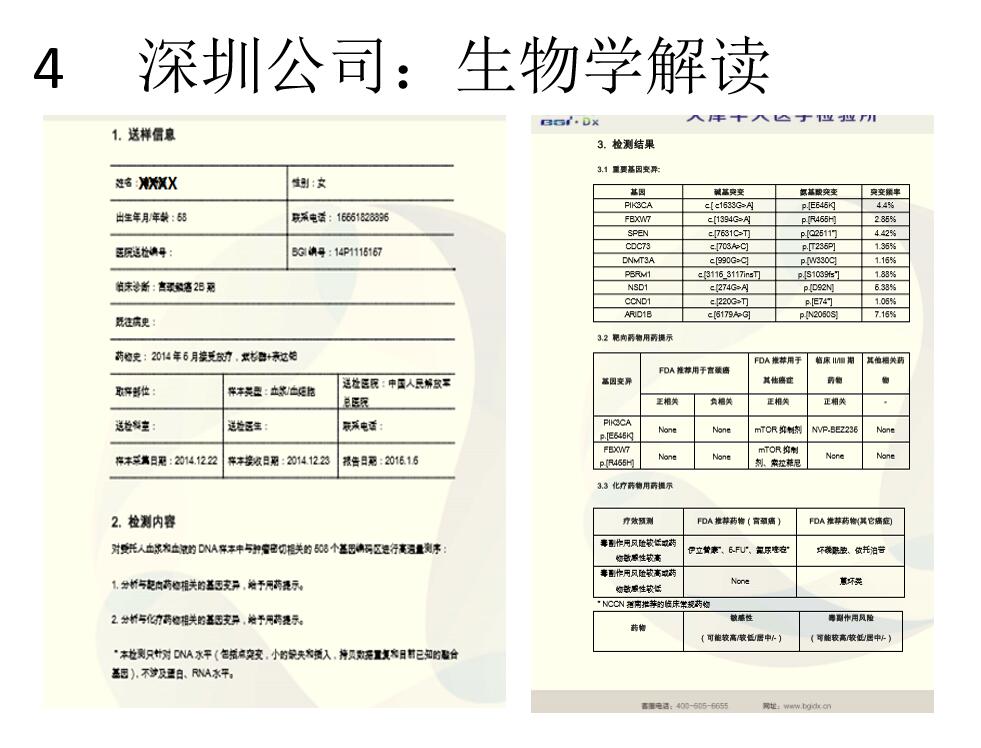
包括深圳公司,最大的基因检测公司给出的结果,也是检测了哪些基因,哪些基因有突变,仅仅把FDA批准的靶向药品的说明书摘录出来,不能提供医学解读。这是我们国内与国外产品的差异。
相应的,我们开发的产品是在国外产品基础上做的,首页会告诉你,哪些药是潜在获益的,我们比国外产品更多了一步:对免疫治疗的响应给出明确的提示,比如说PD-1抗体是获益的。
那我们怎么做到这一点呢?现在肿瘤组织的二代测序很简单,它的数据分析、生物信息学也已经相对解决,就是难在医学解读,我们通过医学解读可以给它的靶向用药、免疫治疗提供指导文件,我们甚至可以通过肿瘤组织测序知道它的肿瘤突变尤其是所谓的驱动突变来挖掘出新生抗原,用新生抗原多肽来刺激培养出T细胞,达到新生抗原免疫治疗的干预手段,这是与国外产品相比,我们多了一个免疫治疗的内容,我们也可以提供私人订制的新生抗原的T细胞治疗方案。更进一步的是,我们对病人通过追踪检测它的循环肿瘤细胞CTC、ctDNA作为疗效指标。

![]()
肿瘤免疫治疗核心
在肿瘤免疫治疗里面的核心是T细胞对肿瘤细胞的杀伤,这需要满足三个条件:
1、肿瘤细胞要递呈一个抗原对T细胞识别,最好的抗原是肿瘤特性抗原,也就是肿瘤细胞通过突变产生了抗原,这样抗原就只在肿瘤细胞有,在正常细胞没有。我们把它叫做新生抗原。
2、我们需要把T细胞的负调控信号通路给封闭住,具体可以通过PD-1抗体或者PD-L1抗体把PD-1和PD-L1的连接打开。如果T细胞在负调控信号的指导下,它的各种杀伤无法进行。
3、足够数量的T细胞,那么多个T细胞可以同时攻击肿瘤细胞,才有一个杀伤的作用。如果体内的T细胞数量不能以倍数级别大于肿瘤细胞,也是不能在体内完成对肿瘤细胞的清除。T细胞数量是决定疗效的的重要因素之一。
那怎么做到呢?对于负调控信号我们可以通过药物的手段来干预,比如说PD-1抗体,更进一步的话可以采用刚才魏教授所以阐述的基因编辑技术CRISPR/Cas9,把T细胞内源性的PD-1给剔除。
另外关于T细胞数量,我们可以在体外培养扩张补充肿瘤病人体内数量不足的肿瘤特异性细胞。更进一步,我们可以用多靶点的抗原负载获得肿瘤特异性细胞而且是多靶点的,这个叫做多抗原的免疫细胞治疗(MASCT)。它可以进行递层肿瘤抗原的DC细胞的回输,同时也可以在体外把DC、淋巴细胞刺激出肿瘤特异性细胞,再过继性地回输。
连用PD抗体和MASCT就是目前最有效的肿瘤细胞免疫治疗,前提是要知道这个肿瘤病原的特异性抗原!
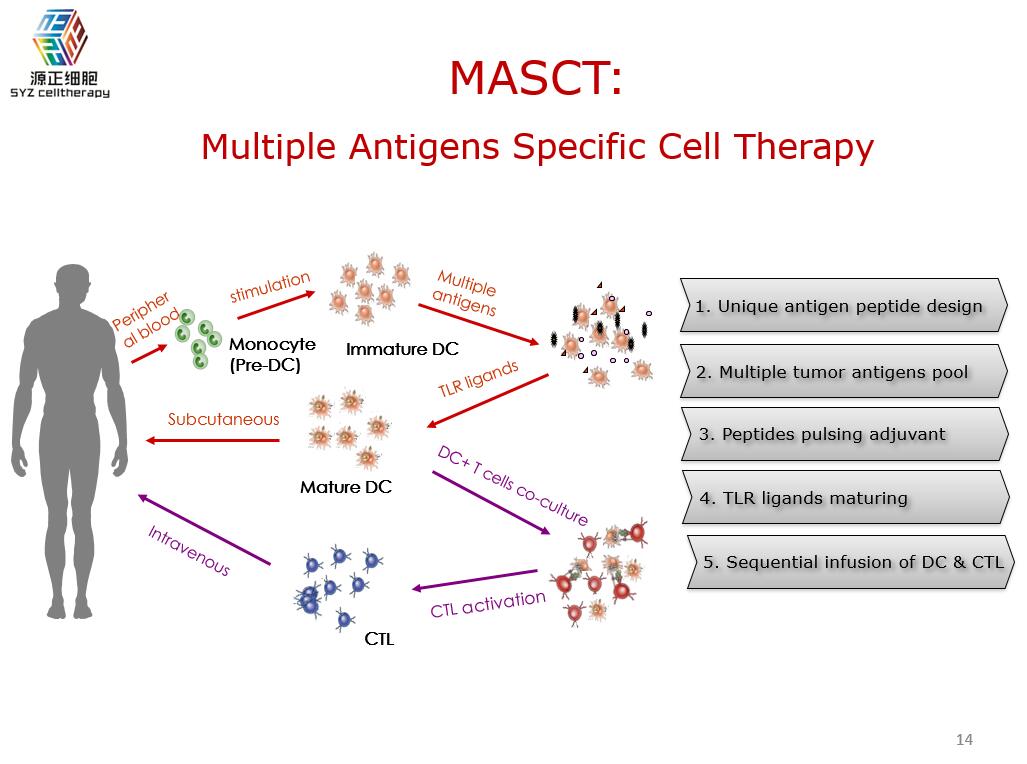
MASCT治疗在国内应用超过三千个例次,它的疗效也在美国免疫治疗学会年会上多次进行报告,疗效的文章目前在审稿之中,很快将会发表出来。
肿瘤精准医疗在临床上的应用
我举几个临床的案例来解释一下肿瘤精准医疗在临床上的应用。
有一个肺癌多发转移的患者,临床上医生做了肺癌常见的EGFR的检测,检测出EGFR突变,建议他用阿法替尼。但是我们给他做精准测疗之后,发现他除了EGFR发生突变以外,他的KRAS也突变了。那我们知道KRAS是EGFR下游的重要信号通路之一,如果KRAS也突变了,那对EGFR的任何医治都会是耐药的。KRAS突变是EGFR靶向药耐药的重要机制。
这时我们给到患者的医学建议是不能应用EGFR靶点的靶向治疗,因为会耐药。这就解释了生物学解读和医学解读的差异点。生物学解读是列出EGFR突变了可以用EGFR的靶向治疗,KRAS突变了就用KRAS的靶向治疗;但是医学解读就会根据病人的整个信号通路情况来综合解读,如果KRAS突变就不能用EGFR的靶向治疗。这就解释了KRAS是EGFR的下游靶点,它的突变用上游的抑制基因是没有效果的。所以我们给出的建议是EGFR阿法替尼会耐药,所以不能应用,这就是一个医学解读。
我们还可以给他检查免疫学的指标,包括HLA的分型测序,评估患者对免疫治疗的响应。
为避免使用耐药药物及跨适应症用药提供依据!
另外一个案例是肾癌肺转移的,在肺转移之后也经过了化疗和靶向治疗,都是无效的,之后我们给他做了源正的精准检测之后,预估他进行免疫治疗可获益,用MASCT和PD-1进行治疗。经过我们5周期治疗后,于8月份复查,肺内肿块消失。
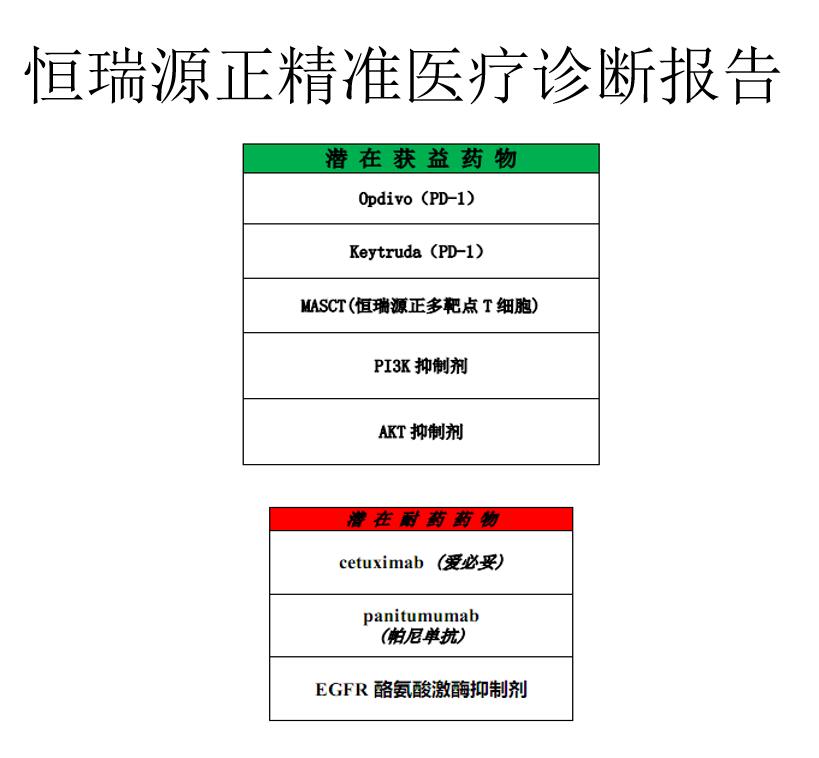
诊断报告中有潜在获益药物和潜在耐用药物,之前病人应用过这些单抗,是没有疗效的。
其他更多案例就不展开了,肺癌脑转也可以接受免疫治疗,病人脑转在脑部有一些水肿占位造成右侧偏瘫,免疫治疗之后水肿的占位消失了,右手偏瘫也消失了。
所以我们的精准免疫治疗通过对基因测序,主要是对肿瘤样本测序,我们检测肿瘤相关突变来挖掘它的驱动突变,同时对它HLA进行分型突变检测,这是我们的精准检测。之后我们还要应用生物信息学数据来评估它对T细胞里MHC限性免疫治疗有效性,预测它有没有T细胞识别表位,这是肿瘤治疗的前提。有的话我们可以根据它的表位合成相应抗原多肽来做T细胞负载。这样我们可以应用PD抗体、MASCT治疗,在治疗后我们可以用影像指标做疗效判断,也可以进一步利用CTC检测,甚至更高灵敏度的ctDNA检测进行监测,进一步我们也可以对患者的外周血进行T细胞的功能检测,知道患者体内究竟是不是存在针对突变靶点的T细胞。
再举一个案例,我们对一个病人进行测序,测序后他的潜在获益药物包括了免疫治疗,测序之后发现有突变,突变之后肿瘤细胞递呈是增强的,TCR识别也增加了,我们就根据这种突变合成了他的抗原肽,用这个抗原肽通过DC负载成熟特异性激活他的T细胞进行回输治疗。
可以看到在之前,他连续的CTC检测都为0,接受源正细胞定期CTC检测之后,2015年10月CTC检测结果高达194个/10ml,在日本复查得到相似结果,在一次MASCT治疗之后降为6个/10ml,两次之后降为0,他目前已经在做第四次的治疗,如果半年他半年都能保持CTC为0,我们再给他做ctDNA检测。
因为CTC检测阳性之后,做传统的PET-CT,不一定能找到病灶,CTC检测是比增强的PET-CT更灵敏,时间上早半年到一年。目前的理论认为,ctDNA检测又能比CTC检测更灵敏,时间上也能早半年到一年。所以我们对患者做进一步CTC、ctDNA检测,我们对患者外周血做ELISPOT检测,检测里面究竟对哪些抗原靶点是有响应的,我们发现患者外周血中存在对新生抗原neoantigen1+2,Kras-3(mutatedKras)较强响应的T淋巴细胞。肿瘤相关抗原MUC1以及端粒酶,p53, survivin, NY‐ESO‐1, MET也都具有一定的响应。提示治疗后产生的新生抗原和肿瘤相关抗原特异性T细胞有效清除CTC。
肿瘤检测和治疗
目前我们对肿瘤检测和治疗是这么认识的,目前在临床上还是以影像学和病理学作为肿瘤诊断治疗的标准和基础,现在已经可以在这个基础上对病理量做二代测序,提供精准医疗的医学解读来指导患者的靶向用药和免疫治疗。

如果以后,在治疗当中影像学完全消失了,我们可以通过对CTC检测判断患者需不需要再继续进行免疫治疗。再进一步如果病人连CTC都没有了,我们可以对他进行TTK天然免疫细胞治疗。以后也许我们可以把ctDNA引入到每年体检的体系里面,肿瘤形成临床症状、影像学需要十年的发展时间,但是ctDNA检测可能在它前三年就可以发现了。这样我们可以通过TTK(天然免疫细胞)、或者通过多靶点细胞MASCT,对这个微下肿瘤细胞进行清除。对西医来讲,他们认为十年内90%的实体瘤可以被治愈,就是对早期检测手段和免疫治疗手段的综合应用。
部分免疫治疗临床实践案例,我们已在4月10日的《中国医药生物技术上杂志》上发表。
谢谢大家!
正文为周向军于论坛上演讲的内容,正文图片来源周向军演讲PPT,其版权归原作者所有。
本文由广东医谷整理,转载请于文章开头注明作者周向军和来自广东医谷。







