20世纪70年代开始,自然杀伤(Natural Killer,NK)细胞既开始进入人们的视线,然而,近40年来,利用NK细胞进行抗肿瘤的治疗的研究却一直没有亮点突破,疗效亦无定论。随着免疫卡控点抑制剂和CAR-T技术等问世,NK细胞能否寻找到新的契机呢?近日Nature Reviews的文章介绍了NK细胞抗肿瘤治疗的新希望。
NK细胞简介
NK细胞是一群不同于T、B淋巴细胞的大颗粒淋巴细胞。其主要来源于骨髓CD34+的淋巴细胞,具有1.识别与溶解肿瘤细胞和病毒感染细胞;2.产生免疫调节性细胞因子两大主要功能,是人体抗感染和防止细胞恶性转化的重要免疫调节细胞。一般将人体内CD3-CD56+淋巴细胞认定为NK细胞,根据细胞上CD56分子表达密度的差异,将NK细胞分为CD56dim和CD56bright两个亚群。CD56dim占NK细胞90%以上,主要为细胞毒作用,表达中度亲和力的IL-2受体(IL-2R),具有更强的杀伤活性;CD56bright可产生大量细胞因子,主要起免疫调节作用,高表达IL-2R。
NK细胞的活化机制
NK细胞的 “动态平衡”状态受细胞表面多种受体蛋白的调控,简言之,分为2类:杀伤细胞活化受体(KAR)和杀伤细胞抑制受体(KIR)。正常情况下,KAR与自身细胞上多糖类抗原结合产生活化信号,同时KIR与MHCI类分子结合,产生抑制信号且占主导地位,以保证自身组织细胞不被破坏(图1a);当细胞表面MHC I类分子发生改变或减少缺失,影响与KIR结合,不能产生抑制性信号,NK则活化,产生杀伤效应(图1b);肿瘤细胞亦可通过过表达表面抗原与KAR结合,此时活化信号超过抑制信号,继而激活NK细胞(图1c);此外,NK细胞还表达IgG1和IgG3的低亲和力受体FcγRIII(CD16),可与肿瘤抗原特异性抗体Fc段结合,介导NK细胞识别并杀伤被抗体包被的肿瘤细胞,亦称为抗体依赖性细胞介导的细胞毒作用(antibody dependentcell-mediated cytotoxicity, ADCC)(图1d)。
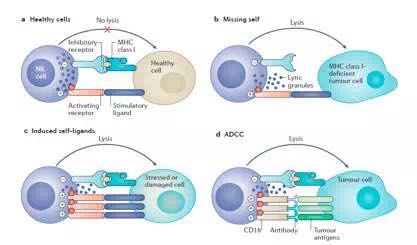
图1. NK细胞功能示意图
NK细胞表面受体
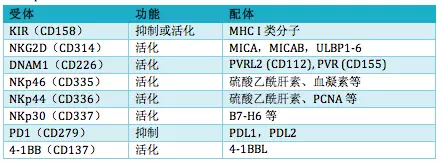
NK细胞识别自我与非我并不需要体细胞基因重排产生识别不同抗原的克隆,而是表达多种受体执行功能。NK细胞受体主要包括免疫球蛋白超家族(如KIR),C型凝集素家族如NKG2受体,天然细胞毒性受体(NCR):NKp46、NKp44和NKp30,下表例举主要的受体及其调节功能:
NK细胞作用机制
目前认为NK细胞主要通过以下途径发挥杀伤作用:1.NK细胞直接通过胞吐作用释放穿孔素和颗粒酶等细胞毒性颗粒,活化caspase途径诱导靶细胞凋亡;2.活化NK细胞表达Fas(CD95)配体和TRAIL(TNF related apoptosisinducing ligand)分子,诱导CD95+靶细胞和TRAIL受体阳性的靶细胞通过内源酶的级联反应发生凋亡;3.细胞因子介导的杀伤作用,NK细胞能合成和分泌多种细胞因子,如IFNγ、TNFα、IL1、IL5、IL8、IL10和GCSF;4. ADCC作用。
肿瘤细胞如何逃逸NK细胞攻击
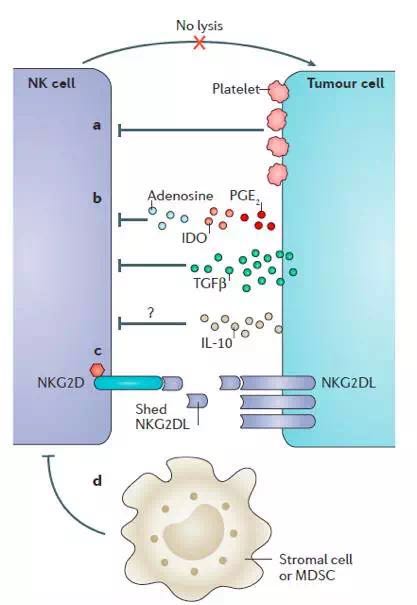
图2. 肿瘤细胞逃逸NK细胞机制
如图2所示,肿瘤细胞主要通过一下途径逃逸NK细胞攻击:a.血小板包被肿瘤细胞,并释放TGF-β等免疫抑制因子,表达GITR配体与KIR结合或下调KAR,抑制NK细胞激活;b.肿瘤细胞分泌免疫调节分子,如PGE2、IDO、TGF-β和IL-10等;c. 肿瘤细胞分泌可溶性NKG2DL,中和NK细胞表面受体;d.肿瘤微环境中基质细胞等分泌免疫抑制因子,表达NKG2DL,下调NK细胞表面受体。
NK细胞与免疫检验点抑制剂
某些激活的NK细胞表达PD1和CTLA4。研究者在多发性骨髓瘤患者体内检测到其NK细胞表达PD1,应用PD1单抗(CT-011)后能修复NK细胞介导的抗肿瘤效应;此外,应用PDL1的IgG1单抗还可能激发NK细胞的ADCC。NK细胞表面KIR类的抑制性受体(KIR2DL1, KIR2DL2 和KIR2DL3)可与MHC I类分子结合,抑制NK细胞活化,体外实验表明,应用IPH2102单抗阻断KIR2DL1-3,可以增加NK细胞的抗肿瘤活性(作用机制图3所示)。在AML和MM的临床I-II期研究已证实anti-KIR的安全性,虽然目前anti-KIR单独应用没有展示出显著的抗肿瘤效应,然而其与CTLA4或PD1抑制剂联用值得期待。
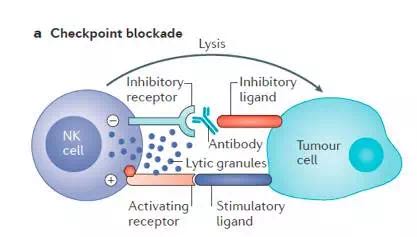
图3. 抗体封闭NK细胞抑制性受体,激活NK细胞
嵌合抗原受体(CAR)技术与NK细胞结合
CRA-T大家都耳熟能详,模仿CAR-T的CAR技术,已研发出CAR-engineeredNK cell(如图4所示),其原理亦是通过在NK细胞表面嵌合肿瘤特异性抗原受体,靶向识别并摧毁肿瘤细胞。体外实验提示,其CAR-engineered NK cell展示出较ADCC更强的细胞毒作用,可能与CAR与肿瘤表面抗原结合较IgG-CD16展示出更强的亲和力,目前CAR-engineered NK cell还处于研发阶段,期待其在体内试验中的疗效。
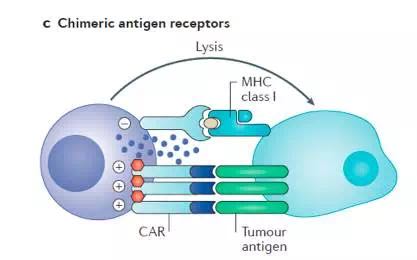
图4. CAR-engineeredNK cell
双特异性分子联结NK细胞活化受体和肿瘤细胞
如图5所示,以NK细胞表面活化受体CD16和NKG2D为靶点的双特异性分子,可以靶向NK细胞识别并杀伤肿瘤细胞。
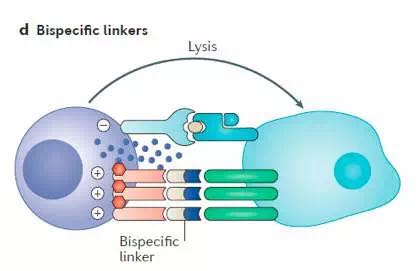
图5. 双特异分子联结NK活化受体和肿瘤细胞
以NK细胞为基础的肿瘤免疫治疗
NK细胞在免疫监视中扮演着非常重要的角色,随着对NK细胞的分子特征和功能的进一步探索,开发以NK细胞为基础的靶向免疫治疗可能引发肿瘤免疫治疗的新突破,图6展示了以NK为基础的潜在免疫治疗靶点。
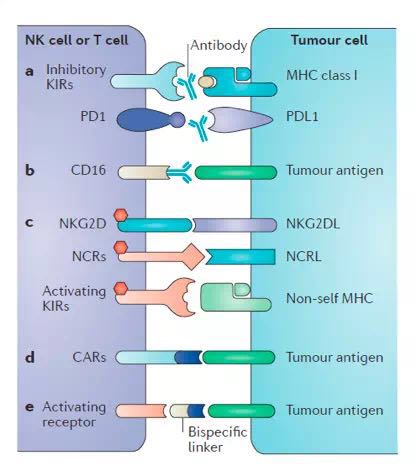
图6. 以NK细胞为基础的肿瘤免疫治疗
结语
在多家巨头纷纷投入CAR-T免疫疗法的同时,以NK细胞为核心的细胞治疗技术公司亦已上市,在概念上,因CAR-engineeredNK cell能敲除NK细胞内抑制性信号通路,似乎更优于CAR-T,是否真如理论所示,我们拭目以待。







