2015年1月20日,美国总统奥巴马在国情咨文演讲中提出“精准医学计划”,一时间“精准医疗”成为一大热门词汇。在美国,精准医疗称为“Precision Medicine”,而早在百余年前的中国,中医就提出了“精准医疗”这一概念,称为“辩证施治”。肿瘤又被称为多基因疾病,其发病机理,疾病发展过程,疾病病症与表现在个体之间差存在异。肿瘤的发生因素很复杂,遗传因素,外环境与内环境以及体细胞与干细胞的DNA损伤与修复,导致基因突变的逐步积累,最终演变为各种癌症的发生(图1)。爱康得Paul认为肿瘤发生的机理如基因突变,逆分化,肿瘤干细胞,免疫监视,端粒与端粒酶等等还有太多的未知领域。这些错综复杂的因素导致相同组织器官癌症引发的机理不一致,相同机理引发的癌症部位不一致。肿瘤的发生往往有数千个突变类型,每个病人的突变类型不一样,所以传统的治疗模式出现了许多困惑,如无法解释的耐药性,肿瘤基因组的异质性,有效治疗响应监测手段的缺乏等,在此时,精准治疗对于肿瘤的治疗十分重要。
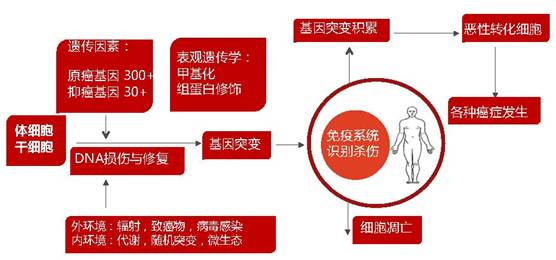
图1:肿瘤发生的复杂性。肿瘤的发生因素很复杂,遗传因素,外环境与内环境以及体细胞与干细胞的DNA损伤与修复,导致基因突变的逐步积累,最终演变为各种癌症的发生。
肿瘤精准免疫治疗发展
当前,广泛用于肿瘤精准免疫治疗的药物为靶向药物和单克隆抗体,其利用肿瘤细胞与正常细胞之间分子生物学上的差异(包括基因、酶、信号转导等不同特性),抑制肿瘤细胞的生长增殖,最后使其死亡。如用于治疗非小细胞肺癌的易瑞沙和特罗凯,用于治疗大肠癌的西妥昔单抗,用于治疗乳腺癌的曲妥珠单抗,用于治疗前列腺癌伊马替尼等。但肿瘤细胞十分狡猾,在靶向药物使用过程中,肿瘤为躲避药物的作用会产生突变,继而产生耐药使这类药物失去效力,如易瑞沙平均耐药时间约1年,特罗凯耐药时间还要更短些,大约在8个月左右。耐药后肿瘤进展十分迅速,病人不得不重新寻找其他治疗方法。
2013年是值得纪念的一年,《科学》杂志评论作为2013年度最重要的科学突破的榜首——癌症的免疫疗法。其中以程序性死亡因子1 抗体(anti-PD1) 及其它免疫检查点抗体和嵌合抗原受体T细胞疗法(CAR-T疗法)最受瞩目。PD-1在恶性黑色素瘤和肺鳞癌的治疗获得重大突破,被美国FDA批准用于临床。CAR-T在B细胞恶性肿瘤的治疗获得巨大成功,ALL完全缓解率达到惊人的90%。在此我们着重聊一聊CAR-T免疫疗法。
CAR-T免疫疗法是通过整合嵌合抗原受体的基因修饰的T细胞来抵抗肿瘤细胞的疗法。嵌合抗原受体可以特异性识别肿瘤相关抗原靶点,识别结合后将激活增殖T细胞的信号传递至胞内,引起T细胞激活和增殖,从而有效杀伤肿瘤细胞。自1989年以色列魏茨曼科学研究所免疫学家Zelig Eshhar将免疫球蛋白scFv与FcεRI受体(γ链)或CD3复合物(ζ链)胞内结构域融合并导入T细胞制备出第一代CAR-T以来,CAR-T经历了20余年的发展(图2)。CAR分子大致可分为5代演变:I代,特异性T细胞激活;II代,增加共刺激因子,提高细胞毒性;III代,同时具有两个共刺激因子,提高T细胞增殖能力与杀伤毒性;IV代,整合自杀基因,精确调控,细胞因子释放(如IL-7,IL-15)激活等;V代,通用型CAR(图3)。
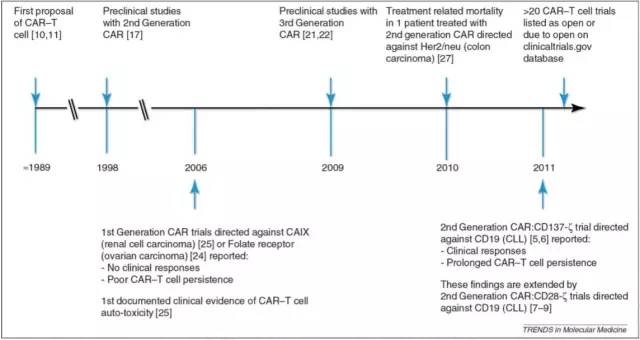 图2:CAR-T的发展历程
图2:CAR-T的发展历程
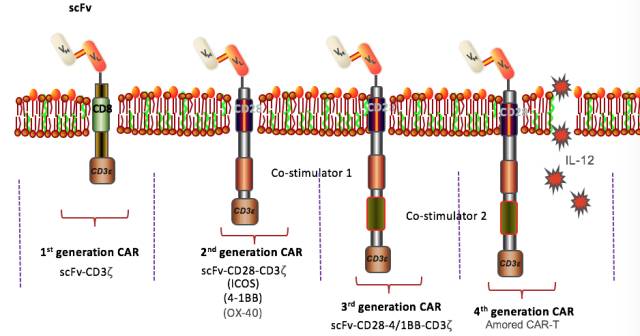
图3:CAR分子的演变。I代,特异性T细胞激活;II代,增加共刺激因子,提高细胞毒性;III代,同时具有两个共刺激因子,提高T细胞增殖能力与杀伤毒性;IV代,整合自杀基因,精确调控,细胞因子释放(如IL-7,IL-15)激活等;V代,通用型CAR
CAR-T临床试验疗效与毒性
在血液恶性肿瘤方面,2014年UPenn利用CD19-CAR-T细胞治疗复发难治性B-ALL,完全缓解率达90%;2015年ASCO会议,MSKCC公布一组数据,CD19-CAR-T治疗B-ALL,32例受试者有29例获完全缓解,CR率达91%。在治疗实体瘤方面,利用HER2-CAR-T治疗HER2+肉瘤患者,共19例患者参与临床实验,输注CAR-T细胞数量逐步升高,无明显CAR-T毒性,部分瘤内有少量T细胞浸润,4例稳定病情达12周~14个月,中位生存期10.3月(5.1~29.1个月)(图4);Mesothelin是一个肿瘤相关抗原,在很多恶性胸膜间皮瘤中广泛高表达。以Meso为靶点,通过在T细胞上瞬时表达CAR分子,经静脉回输外加瘤内注射的方式对2例入选患者进行治疗,未出现明显的副作用,CAR-T细胞在两例患者体内均体现了一定的抗肿瘤活性,患者腹水中的Mesothelin阳性的肿瘤细胞数量明显减少(图5)。
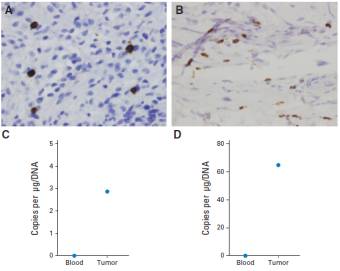

图4:HER2-CAR-T治疗HER2+肉瘤患临床疗效观察。部分瘤内有少量T细胞浸润,4例稳定病情达12周~14个月,中位生存期10.3月(5.1~29.1个月)。
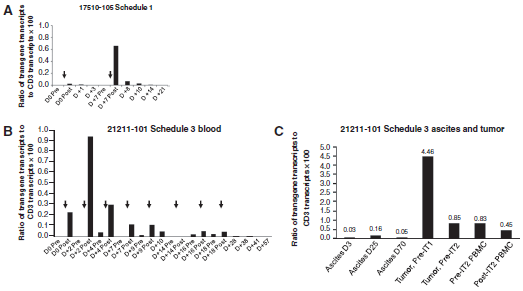

图5:以Meso为靶点,通过在T细胞上瞬时表达CAR分子,经静脉回输外加瘤内注射的方式对2例入选患者进行治疗,未出现明显的副作用,CAR-T细胞在两例患者体内均体现了一定的抗肿瘤活性,患者腹水中的Mesothelin阳性的肿瘤细胞数量明显减少。
接受CAR-T治疗的患者会出现毒性反应。如寒战,发热,白细胞减少,溶瘤综合症,巨噬细胞活化综合症,细胞因子风暴,B细胞缺乏及低丙种球蛋白血症,脱靶效应(on target/off tumor)等。其中几乎所有接受CAR-T细胞治疗并且出现应答的患者都会出现细胞因子风暴,这与T细胞的激活直接相关,而肿瘤负荷影响细胞因子风暴的级别(分为1~4级)。通过输注前化疗预处理,使用输注细胞剂量递增方案,并严密监测血清相关指标,如IL-6水平,C-反应蛋白等。利用IL-6拮抗剂如Tocilizumab可治疗严重细胞因子风暴,并且不会影响CAR-T疗效。脱靶效应常见于CAR-T治疗实体瘤患者中,由于靶向抗原在正常组织中也低表达,导致CAR-T细胞攻击人正常组织,如人肺组织会低表达Her2,Her2-CAR-T细胞可引起致命的肺毒性。爱康得Paul认为通过降低scFv亲和力,局部瘤内注射,寻找肿瘤特异性抗原等方法来减少或避免这类毒性的发生。由此可见,目前CAR-T细胞治疗还不够精准。
CAR-T临床试验数据统计与治疗方案研究
截至2015年10月,全球共计110项CAR-T临床试验在ClinicalTrials.gov注册,其中大部分为血液肿瘤的临床试验,实体瘤占38项,均为I/II期临床试验(表1),血液肿瘤靶点选择最多的是CD19,实体瘤主要靶点选择是EGFR,GD2,CEA,Her2(图6)。
表1:CAR-T实体瘤临床试验在ClinicalTrials.gov注册情况(截至2015.10)
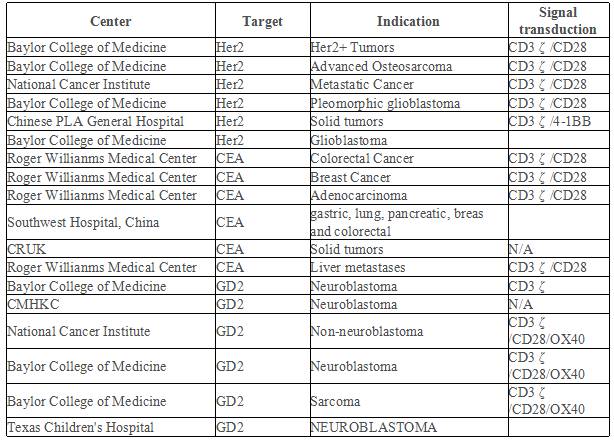
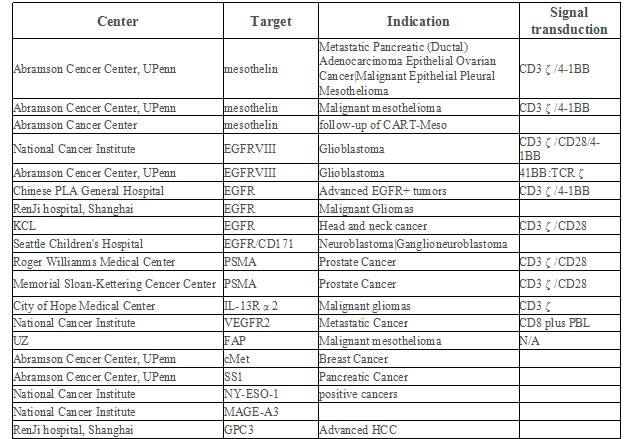
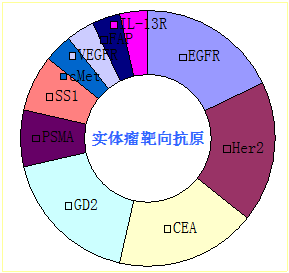
图6:实体瘤靶向抗原选择比例图
在临床试验中,血液肿瘤的CAR-T治疗方案为:在获得临床试验批准后,首先根据入选与排除标准筛选受试者,与受试者签署知情同意书后对其病情进行评估,采集分离PBMC,经T细胞分选,CAR病毒感染,洗脱扩增,质控检测后收获CAR-T细胞。在细胞输注前4天完成化疗预处理。连续3天按10%,30%,60%的剂量递增方式输注CAR-T细胞。输注后半年内月度随访和半年后的季度随访,以及15年后的转基因跟踪。
实体肿瘤的CAR-T治疗没有获得如血液肿瘤治疗后的惊人疗效。爱康得Paul认为实体肿瘤的治疗情况相对复杂多变。首实体肿瘤致密结构特点阻碍了CAR-T对肿瘤组织的浸润,导致实体瘤内部没有足够的效应T细胞;再者肿瘤微环境中存在免疫负调节因素的制约,如免疫抑制性细胞的存在(regulatory T cells, myeloid derived suppressor cells, and M2 tumor-associated macrophages),抑制性细胞因子(TGF-β, IL-10),肿瘤细胞表面表达的T细胞功能抑制性蛋白分子 (B7-H family members, Fas ligand)等。所以,CAR-T细胞输注前患者预处理方案,如何让CAR-T细胞在体内有效增殖并保持高杀瘤活性,如何使CAR-T细胞有效浸润在实体瘤内部等一系列问题尚待进一步研究。如使用CT模拟定位三维适形放疗技术对实体瘤进行预处理,或用微创介入或瘤内注射的方式,使CAR-T细胞更多地进入到实体瘤内部对靶细胞进行有效杀伤。另外可以将CAR-T负载溶瘤病毒以提高对实体瘤治疗的效果(详见《CAR-T细胞与溶瘤病毒联用》一文)。
小结
精准医疗是未来疾病治疗的发展方向,但是目前肿瘤的精准治疗长路漫漫。如果将肿瘤比喻为阴,免疫系统比喻为阳,则阴阳之间相互对立,相互统一,相互制约,消长与共(图7)。
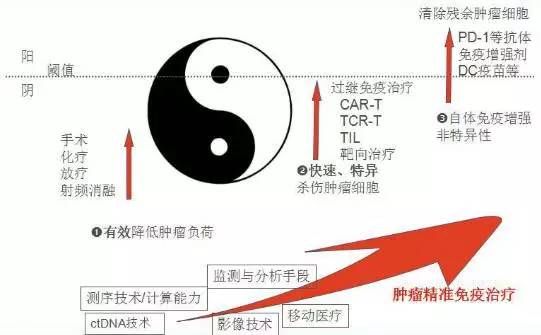
图7:肿瘤与免疫治疗之间相互对立,相互统一,相互制约,消长与共
仅依靠细胞治疗肿瘤还远远不够。手术,化疗,放疗可以迅速降低肿瘤负荷,特异性治疗如CAR-T,TCR-T,抗体药物等可以迅速锁定并杀伤肿瘤细胞,但是肿瘤而且很容易产生突变,使用非特异性治疗如DC疫苗,免疫增强剂来清除残余的肿瘤细胞。随着基因测序,分子生物学技术,影像技术,大数据等快速发展,肿瘤的精准治疗也会得到长足的发展,并成为未来肿瘤综合治疗的主要模式。不过在最后笔者认为,对于肿瘤,做到健康规律的生活方式,高危人群定期进行健康体检,以预防为主,早发现,及时并且根据病情进行综合治疗,方为正道。
本文由爱康得生物医学技术(苏州)有限公司 转化医学部高级经理Paul Hsu原创,转载请标明出处。







