讲者:北京大学肿瘤医院 沈琳
胃癌的诊治现状
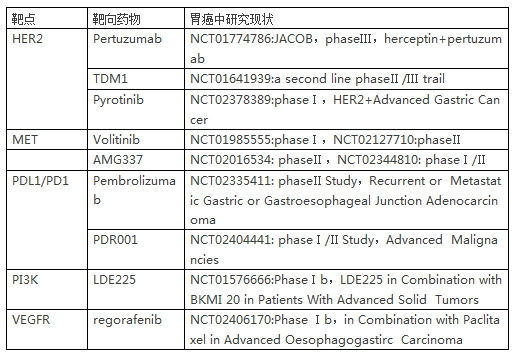
我国进展期胃癌比例高,约占所有胃癌患者的70%。进展期胃癌的治疗以化疗及靶向治疗为主的综合治疗。晚期胃癌患者的中位生存期仍不足1年,5年生存率在全国范围来说约31%。但是我国胃癌患者的5年生存率与日韩等国家相比仍存在一定的差距,因此在这一人群中药物治疗是我们重点研究的方向之一。尽管近年来我们在肿瘤领域做了大量的努力,但是在胃癌领域的进展是非常有限的。胃癌领域的研究最大的困难就是异质性,因此如果“以偏概全”的结果必然是失败。
尽管目前胃癌靶向药物的临床研究也有很多,但其中的很多研究还是在筛选出来的人群中进行的,究竟这些研究最终能否为胃癌的靶向治疗提供帮助我们都需要等待进一步研究结果的公布。
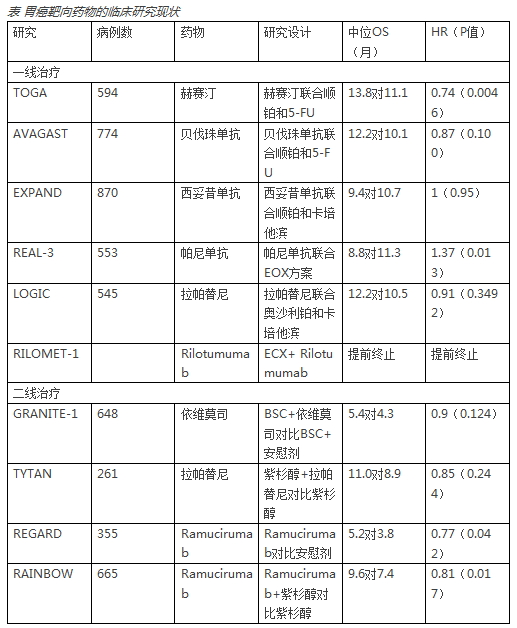
表 正在进行中的胃癌靶向药物的临床研究
胃癌的临床研究成功少、失败多,良好的临床前研究模型至关重要。临床研究失败的可能原因包括:
① 胃癌本身的复杂性,异质性强,存在多种信号通路的异常;
② 缺乏抗胃癌新药的疗效标志物。
在临床前研究中进一步明确胃癌靶向药物的抗肿瘤作用极可能的疗效标志物具有重要意义。体外筛选对患者最为有效的药物,为临床决策提供依据,实现肿瘤的个体化治疗。
胃癌临床前研究模型
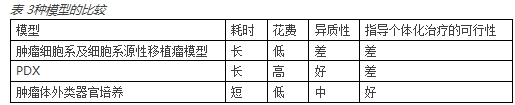
模拟人体内肿瘤模型是实现精准医疗最重要的媒介之一。临床前研究模型包括肿瘤细胞系及细胞系源性移植瘤模型、人源性移植瘤模型(patient-derived xenograft,PDX)、肿瘤体外类器官培养(organoids culture)。
1、肿瘤细胞系及细胞系源性移植瘤模型:
细胞系是将患者的组织或经小鼠体内传代的肿瘤组织,经过机械法和(或)酶解法分离消化并进行体外传代培养而建立。该模型的优势在于操作简单,可操控性强,易于进行传代培养;可进行高通量药物筛选;花费较低。缺点包括体外培养的细胞系脱离了正常的肿瘤微环境,生物学功能发生改变;在体外培养过程中,在选择压力作用下,肿瘤的异质性缺失;利用实体瘤建立细胞系的成功率低(乳腺癌成功率<=10%,不利于指导患者临床用药和实现个体化治疗。也就是说,体外培养的肿瘤系与体内肿瘤组织具有较大差异,从而不能很好的预测抗肿瘤药物的临床疗效。
2、人源性移植瘤模型 :
该模型是直接将患者新鲜的肿瘤组织或细胞接种到免疫缺陷小鼠中而建立起来的动物模型。该模型的特征包括保留了肿瘤的组织病理学特点、肿瘤组织的分子遗传学特性以及肿瘤的异质性,并且模拟人体对药物治疗的应答性。
目前PDX已经在肺癌、乳腺癌、肾癌、结直肠癌及胃癌等多种肿瘤中被成功建立。在胃癌领域,PDX实际上并不是新近几年才出现的,回顾PDX在胃癌方面的研究可以发现绝大部分研究是在手术标本的基础上建立PDX模型的,这是因为在手术标本获得的样本量较大,比较容易存活。
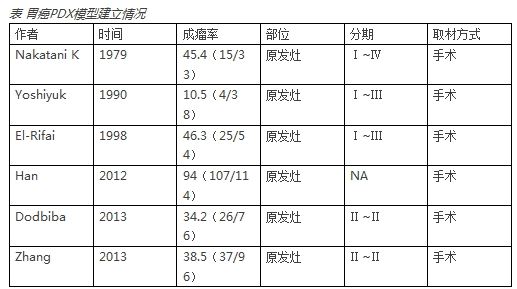
由于晚期胃癌的患者没有太多的手术机会,因此对于这类患者可以采取原发灶的生物活检的方式建立PDX模型。此外,PDX还可以由循环肿瘤细胞(CTC)所建,但该方法操作要求高,较为困难。一般是将患者的血液标本注射到免疫缺陷小鼠的骨髓腔中,经过6~12个月的发展,试验小鼠中发生了多发的骨、肺及肝脏转移。血液循环中存在的肿瘤细胞很多都是与肿瘤的预后和复发转移是有关的。
PDX的价值包括:
① 评价新药,用于检测新的抗肿瘤药物的疗效和不良反应等;
② 筛选抗肿瘤药物的疗效标志物;
③ 由于人体内耐药研究受到取材等的限制,而PDX可用于研究抗肿瘤药物的耐药机制;
④ 指导临床个体化治疗,由于药物在PDX即患者中的疗效具有良好的一致性,因此在临床进一步治疗前对相应患者的PDX进行药物筛选,可能有助于寻找最佳药物,指导对患者进行个体化治疗。
在精准医疗的时代,该模型可能能够为患者带来更多的获益,未来也可能会有较好的发展前景。
高通量测序可提供患者的基因组特征,为临床决策提供依据。大门是对许多的基因改变,如何选择最好的治疗靶点及药物治疗?如果测序未能发现可能的治疗靶点,应该如何选择药物?
PDX的缺陷包括:
① 人源性肿瘤间质成分被鼠间组织取代、缺乏肿瘤免疫;
② 药物的药代动力学在人体与小鼠中可能存在差异,影响了PDX对药物疗效的预测价值;
③ 成功率较低(胃镜活检PDX约为35%),且PDX建立所需时间较长,花费较高,从而限制了其在指导个体化治疗方面的应用;
④ 可以发生淋巴瘤转移,影响后续应用。
3、肿瘤体外类器官培养 :
类器官培养(organold culture),又称三维培养(three dimensional culture),是将具有三维结构的不同材料的载体与各种不同种类的细胞或组织在体外共同培养,使细胞能够在载体的三维立体空间结构中迁移、生长,构成三维的细胞载体复合物。
目前在前列腺癌、乳腺癌、大肠癌、胃癌、胰腺癌等多种肿瘤及前列腺癌及乳腺癌的正常组织中都已经成功建立3-D培养模型。
类器官培养模型的优势在于:
① 直观性和可操控性强;
② 基因特征及生物学行为与原发肿瘤具有较好的一致性;
③ 建立模型耗时短,成功率高,花费较低;
④ 可在体外进行高通量的药物筛选,为肿瘤的个体化治疗提供良好平台;
⑤ 可同时进行癌旁正常组织的培养,从而为药物筛选提供对照。
但是,该模型也还存在一些缺陷,例如缺乏肿瘤间质及脉管系统;目前仅在少数几种实体瘤中被成功建立,培养技术有待于进一步完善;活检标本的培养具有一定的挑战。