2012和2013年,由北京大学多个研究团队合作完成的世界首个高精度人类男性和女性个人遗传图谱相关论文相继发表于《科学》和《细胞》杂志。这一工作采用的单细胞DNA扩增技术MALBAC,与以前的技术相比,该技术将单细胞全基因组测序的精确度大幅度提高,以至于能够发现个别细胞之间的遗传差异。
MALBAC技术是由北京大学生物动态光学成像中心(BIOPIC)主任、哈佛大学终身教授、美国科学院院士谢晓亮领导的团队发明。他们的工作不仅大大拓展了单细胞基因组学研究技术,而且给现代医学带来了革命性的突破,是“精准医学”的一个最佳范例 。
通过与BIOPIC的汤富酬教授团队、北京大学第三医院院长乔杰团队的合作,2014年下半年,两对携带遗传疾病致病基因的夫妇在MALBAC技术的帮助下成功生下了健康的婴儿。此外,MALBAC技术还正在用于探索针对肿瘤患者的个体化诊断和治疗方案。
2015年7月18日,谢晓亮应邀在“未来论坛”上发表题为“单分子水平上的生命——通往精准医学之路”的演讲,回顾并展望了他在单分子基因组学上的基础研究和生物医学应用的探索之路。
北京大学生命科学院饶毅教授在现场介绍他时说:“谢晓亮的第一个基础研究工作是1998年开展的单分子酶学,他开创了在单分子层面对生命过程的研究。近年他又开始探探索在医学上的应用。中国引进现代医学后,在现代药学方面只有少数几个药物作用领域的发现,在现代医学技术上唯一的发明和应用就是谢晓亮和汤富酬、乔杰三个团队合作诞生的‘MALBAC婴儿’。”
中国医学科学院院长曹雪涛认为,谢晓亮的MALBAC技术能够改变整个生物医学,其对未来精准医学的发展和应用的贡献是不可限量的。
“获得终身教授的人很多,但真正能够在人类历史上,特别是科技史上留下印记的科学家非常少见,而谢晓亮将理论和技术结合,用技术解决科学问题,是引领整个科学界发展的真正的一流科学家。”曹雪涛评价说:“他是一个让你无法预知将来还会做出什么创造性工作的科学家。这是一个科学家具有潜在创造力、影响力、引领力的标志。”
以下是根据现场录音和演讲PPT整理的演讲全文,全文已由谢晓亮教授审阅。
女士们、先生们:
我今天的讲座内容跨度会比较大,从物理学到化学、到生物、到医学。
著名的物理学家理查德•费曼(Richard Feynman)曾经说过:“如果要用一句话来描述我们拥有的最重要的科学知识,这句话应该是:所有物质都是原子组成。”原子在宇宙中比比皆是,但是如果只有独立的原子,我们的世界会变得非常无趣,没有生命、没有爱。原子间的相互作用导致分子的产生,分子们进行化学反应,产生新的分子,这才有了生命。
那么如果要用一句话来形容过去半个多世纪生命科学的主要进展,这句话应该是什么?我想应该是:生命过程可以在分子水平上得到解释。
单分子成像技术开启研究生涯
我在北大读本科时学的是化学,生物是到美国才学的。我1985年离开北大,来到美国加州大学圣地亚哥分校,攻读物理化学博士学位。我因从小就喜欢动手,在美国学的是用超快激光来研究化学反应动力学。
在化学和生物化学的教科书里,分子相互作用和化学反应总是在单分子的水平上描述的,可是迄今为止,我们的化学知识几乎都是从含有大量分子的实验中得到的,量大到摩尔(mole)的数量级。1摩尔是2克氢分子的分子数目,被称作“阿伏伽德罗常数”。阿伏伽德罗是意大利的化学家、物理学家,虽然他定义了阿伏伽德罗常数,但他只知道这是一个非常大的数,直到死也不知道到底是多大。现在我们知道,阿伏伽德罗常数是6.023x1023,这是个天文数字,我估算了一下,1摩尔1立方毫米的沙子,如果平铺在中国大地上,可以形成一个60米深的沙漠。
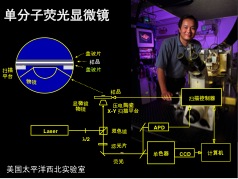
90年代初,我在美国太平洋西北国家实验室开始了我的独立研究生涯,带领一个团队研究在常温下用荧光来检测单个分子(见上图)。当时的研究非常令人兴奋,有几个小组在竞争,去年因为超分辨率荧光显微技术获得诺贝尔化学奖的两位科学家Eric Betzig和W.E. Moerner那时也在做同样的事。1994年7月,我第一次在《科学》杂志上发表了文章,研究单分子的动态过程。在此前的研究生和博士后阶段,我还没在《科学》或《自然》杂志上发表过文章。
这篇文章是和我的第一个博士后Bob Dunn合作的。当我们把这些技术发展起来以后,我有了一个预感,单分子技术在生物化学和分子生物学上将有重要的应用。所以我们就开始研究酶。
酶是生物过程的催化剂,加速生物化学的反应。我们把带有荧光的胆固醇氧化酶分子固定在99%的琼胶中,让它们不能游动,以便我们长时间地观察胆固醇酶催化的胆固醇氧化反应。
这个酶有两个态,在氧化态下,它有天然的荧光,在还原态下,它不会发光。酶作为生物催化剂,它在这两个态之间循环,自己最后是没有变化的。所以当我们观测单个酶分子的荧光时,每一次荧光的“亮/灭”就对应着一个酶分子催化状态的循环。这使我们第一次实时观测到了单个酶分子的化学反应。在单分子层面上,化学反应是随机发生的,即化学反应发生所需的等待时间是随机分布的,而不像在拥有大量分子系统中的反应里,有可被推测的结果。因此单个酶分子的荧光强度随时间变化的曲线是不会在下一个实验中重复出现的,尽管这个曲线的统计结果是可以重复的。
因为这个工作,哈佛大学给了我一个资深教授的职位。这个工作之所以重要,是因为很多生物大分子,比如DNA是以单分子或者少量几个分子的形式存在于细胞之中的,这个工作让人们能对单分子的生物化学反应进行实时观察。
大家知道,20世纪最重要的生物学发现是沃森(Watson)和克里克(Crick)解出遗传分子DNA的双螺旋结构。DNA是由四种碱基(A、T和C、G)配对构成的。遗传信息储存在碱基的序列里。
单分子酶学也具有实际应用意义。比如有人做了与我们类似的实验,造出了两个单分子DNA测序仪,其中一个美国加州的公司做的Pacbio测序仪,通过监测单个合成DNA的酶分子,将有荧光标记的四个碱基逐个加入到DNA模版上,以直接读取DNA分子的序列。这个技术的特点是它能够测很长的DNA序列。
在基础研究领域,单分子生物学增进了我们对许多生物大分子工作机理的深入了解,让我们在活细胞里直接观测蛋白质分子的逐个产生。分子生物学的中心法则告诉我们,在DNA上的遗传基因会转录成mRNA,在翻译过程中mRNA导致蛋白质的合成。
由于一个基因在单个活细胞里只有1到2个拷贝,基因表达过程就跟单个酶分子反应一样,也是随机发生的,所以单分子生物学与单细胞生物学是密切相关的。我们对单个活细胞的基因表达进行了非常详细的研究,从而使得分子生物学的中心法则得到了定量的描述。

上图右边的机体细胞有同样的基因和基因组,我们说它有同样的基因型,但它们有不同的表型,一个有荧光,一个没有荧光。这个细胞从一个表型变到另外一个表型,从没有荧光的状态变到有荧光的状态,可以证明这个过程完全是由于单个蛋白质分子从DNA的单链上随机脱落下来造成的。我觉得这是一个非常普遍的现象,单分子的小概率事件可以导致非常重要的生物学结果。
基因突变也是这样。这个基因型和表型的关系跟我生活中最大的奥秘是相连的,我的两个女儿是同卵双胞胎。同卵双胞胎被普遍认为有相同的基因组,我的双胞胎女儿确实非常相似,但她们有各自的特点,也许这跟基因表达的随机性是相关的。最近有研究表明,同卵双胞胎的基因组实际上是不一样的,因为我们的基因都是随时间变化的。不管怎么说,基因型和表型的关联是生物学中非常重要的一个问题。
破解基因组的奥秘
生物遗传学起源于孟德尔的遗传法则。孟德尔是一位牧师,他的伟大是去世之后才被人们认可的。几个月前,我应邀在捷克斯洛伐克给了一个“孟德尔讲座”,有幸在他曾经工作过的修道院(见下图)做了报告。
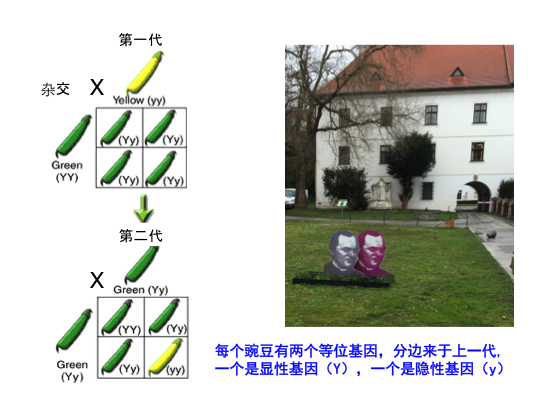
(右图是孟德尔种植豌豆的田地,其上是他的雕像)
孟德尔的实验(见上图左图)是把绿色的豌豆和黄色的豌豆杂交,开始是用纯种豌豆杂交,杂交的结果还是绿色的,后来他把两个杂交出的绿豌豆再次杂交,就发现有1/4的几率可以得到黄色的豌豆。通过这个实验,他推断每个豌豆有2个等位基因,分别来源于上一代,一个是显性基因(绿色),一个是隐性基因(黄色)。
后来人们发现,人类也遵循类似的遗传法则。人的体细胞与豌豆一样,正常情况下都是双倍体,有46条染色体,其中23条来自父亲,23条来自母亲。染色体存在于细胞核内,是46条不同的DNA分子。它们有60亿对碱基,携带2万个基因。(编者注:人类基因组由30亿对碱基构成,分布于23条独立的染色体中。人类的体细胞是双倍体含有46条染色体,生殖细胞是单倍体,含有23条染色体。体细胞中的两套染色体分别源于父亲和母亲,它们所包含的碱基有微小的差异,因此人的全基因组包括约60亿对碱基)。
基因组的主要变化是点突变(SNV)和基因拷贝数的变化( CNV)。我们每个人之间的不同就是由于点突变,也就是单碱基发生了变化。60亿对碱基中大约只有千分之一的碱基在人与人之间是不同的。另外一个基因组产生变化的是基因拷贝数的变化(CNV)。一般来讲,基因拷贝数应该是2,一个来自于父亲,一个来自于母亲,形成两个等位基因。但有的时候,特别是发生癌症的时候,拷贝数可以变成1,3或者4,这叫染色体不正常。
2001年人类基因组计划完成,也就是这30亿对碱基的顺序被测定了,这是人类历史上的一个里程碑,意义重大。当时美国的一个私人公司(领导人是Craig Venter)和美国组织的国际团队(领导人是现任美国国家卫生局主任Francis Colon)展开了激烈的竞争,他们分别在《科学》杂志和《自然》杂志上发表文章。这项工作花了30多亿美金,用的方法是第一代电泳技术。这是1980年获得诺贝尔奖的技术,是由Fred Sanger(1918-2013)做出的。这是一个传统的办法,通过测DNA的长短来测序。
以这个技术为基础研发的第一代测序仪由美国公司ABI生产,该产品是产学研结合的范例。加州理工学院的教授Leroy Hood和他的研究生Mike Hunkapiller先在他们的实验室里改造了传统的 DNA测序方法,把电泳的方法用到毛细管里,用激光来代替放射性DNA监测仪,然后成立了ABI公司。这是一家车库公司,但后来这家公司很快垄断了世界测序仪市场。刚才说的参与人类基因组计划测序竞争的私人公司领导人Craig Venter就是买了250台这种仪器来完成的人类基因组的测序。
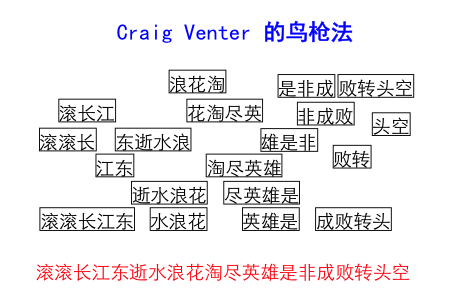
Craig Venter的一大科学贡献是把人类的基因库组装起来,他发明的方法是很有意思的“鸟枪法”。比如说我要知道《三国演义》这本书里文字的序列,但是我能得到的只是打碎的一行一行的片段。Venter的方法是找很多本《三国演义》,然后打碎成一行一行的,由于是随机的,所以每行的断裂都不一样,然后把得到的千千万万碎片上下重叠起来,就可以得到《三国演义》中原始的文字序列(见下图)。当时没有人觉得这个方法可行,而Venter坚信可以由此得到百分之八、九十的人类基因序列,虽然不是100%,但已经很了不起了。
如今十几年过去了,测序仪技术有了突飞猛进的发展。2007年以来,新一代的DNA测序仪层出不穷,主要是因为CCD(电荷耦合元件)的应用,使得大家可以在很多不同的位置上观测大量的序列,提高测序通量,这样一来,测序价格的衰减比指数衰减还快。现在如果你想测你的基因组,一天之内就可以完成,价格大概1000美金。其中Illumina公司的仪器占据了90%的市场。第三代测序仪是单分子测序仪,但它现在在成本、准确性和通量方面还不能与基于大量分子的DNA测序仪相竞争。
我的哈佛实验室也做过一个测序仪,但是我们起步比较晚,这是因为到哈佛以后要学怎么做教授,怎么教书,怎样申请基金。 我们只发表了一篇文章,没形成产品。中国目前还没有自己的测序仪,但就像中国需要自己的飞机一样,中国也需要自己的测序仪。这几年我和北大的黄岩谊教授一直在合作做这个工作。
哈佛实验室的新发明
新一代测序仪对医学的贡献是革命性的,它使个体化医疗成为可能。什么是个体化医疗?就是通过个人的基因组测序,为预防、检测和治疗疾病提供个体化的解决方案,所以基因测序成为了个体化医疗的基础。
一个著名的例子是,美国好莱坞影星安吉丽娜•茱莉公开宣布她切除了乳房,因为她知道自己携带一个有缺陷的基因BRAC1,她的医生估算过,她有87%的几率患乳腺癌,50%的几率患卵巢癌。她宣布切除乳房的这一天,是2013年5月13日,当时我正好在美国卫生局进行一个申请项目的答辩。我的实验室有一种技术,可以让父母避免把严重的遗传病遗传给胎儿。评审委员会听到朱莉的新闻后就问我,如果把我的技术用来避免把有缺陷的基因遗传给下一代,伦理上行不行?我当时还没想好,结果这个项目没有在美国启动。关于伦理问题,我到今天也没有一个好的答案。但我今天想告诉大家,我们这两年在北京大学的一个工作,是伦理上可以接受的。
这个新技术对我来讲是一个新的单分子实验。如果给我一个人的体细胞,我能告诉你这个人的基因组,就是46条染色体的序列是什么样的。
我们以前是测多细胞的,抽10毫升血来测。那么我们为什么要测单细胞的基因组?因为由于种种原因,基因组对每个细胞来讲都不相同。比如说人类生殖细胞(精子、卵子)在分裂时发生随机重组,使得每个生殖细胞都不相同。另外癌细胞中剧烈的基因组变化,也使得原发肿瘤中的细胞之间存在高度不同。
刚才说到在一个细胞中最常见的基因组改变包括点突变和基因拷贝数变化。这种变化是单分子的变化,所以是随机的,不同细胞是不同步的,不知道它什么时候发生,也不知道它在哪发生,因此每个细胞都拥有不同的基因组,这使得单细胞测序成为必须。只不过以前技术上不可行。到目前为止,还没有一台单分子测序仪可以把46条染色体从头测到尾进行测序,我们必须借助于单细胞基因组的扩增,就是把46条染色体放大,然后进行高通量的测序。
第一种方法是PCR(聚合酶链式反应)技术,这是一个在1985年获得诺贝尔奖的技术,有单拷贝的高灵敏度。在犯罪现场,只要拿到一个DNA分子,我们就可以把信号放大到被检测的点。但是如果用它来覆盖全基因组,指数放大覆盖率只有6%。因为PCR技术是指数放大,让一个DNA变成两个,两个变成四个。这种指数放大过程不够精确,因为它是对拷贝进行拷贝,一旦拷贝件出错,错误就会被传下去,结果就不准了。
2012年,我在哈佛的实验室发明了新的单细胞扩增方法——“多重退火环状循环扩增法”(MALBAC)。它的最大优势是线性扩增,而不是指数扩增,不针对DNA拷贝再做拷贝,我们只拷贝原始DNA。就像一台复印机把原始的一份文件复制成多份,如果一次复制出错的话,在扩增后的产物里是微不足道的。哪怕单个细胞的30亿个碱基对里有一个碱基错了,我们都能看出来,而且没有假阳性。这种方法比此前广泛应用的MDA(多重置换扩增)方法能更准确地检测SNV(点突变)和CNV(拷贝数变异),将覆盖率大大提高到了93%。
做出这个工作的是我哈佛实验室的博士后宗诚航和我当时的博士研究生陆思嘉。目前,宗诚航正在 Baylor College of Medicine 做助理教授。陆思嘉在哈佛的博士论文就是关于MALBAC技术。他想看到他毕业论文的社会效应,所以两年前回国跟我创立了做单细胞测序的公司——亿康基因。他目前担任亿康基因的CTO。
我们当时做的第一个实验就是测单个精子的序列。精子作为生殖细胞,是单倍体,有23条染色体,其中一半基因来自父亲,一半基因来自母亲。

如图所示,绿的是父源DNA,红的是母源DNA,每条染色体都是父源和母源基因的组合。由于基因组合交结的地方不一样,所以每个精子的序列都是不一样的。这就是为什么兄弟姐妹都不一样。
这项工作是与我以前BIOPIC的同事李瑞强教授合作的。精子来源于一位华人教授,我们检测了他的99个精子,发现了几个染色体不正常的精子细胞,其中一个缺第19号染色体,一个6号染色体出现了2个拷贝。好在这个人还算正常,因为任何一个正常的男子都会有~5%的精子出现拷贝数不正常的现象。这种不正常是由于细胞分裂时染色体没有正常分裂。这种染色体不正常的精子会导致生殖障碍、流产、胚胎停育或者唐氏综合症等遗传疾病,尽管父母看起来完全健康,但就是有5%的出错几率。对男子而言,这5%的几率是不随年龄变化而变化的。但对女士的卵子来讲,染色体不正常的几率在30岁之前是25%,此后很快随年龄的增长而上升,到40岁的时候是70%。这就导致发生生殖障碍的比率和流产的比率随年龄的增长而增加,生育成功率则随年龄的增长而递减。
利用MALBAC技术,我们可以选择一个染色体正常的受精卵来提高生育成功率,特别是对高龄产妇。这是可能的,因为她们染色体不正常的几率并不是100%,即使在43岁以后,妇女仍然有正常的卵细胞,只不过几率小一些。即使是50多岁的妇女,只要有一个染色体正常的受精卵,不管是本人的还是别人捐献的,她怀孕的成功率就和年轻妇女一样。也就是说有一个好的卵子是正常生育的前提条件。
中国是一个人口大国,出生缺陷率高,遗传疾病患者多,大概有1%。不孕不育的夫妇也越来越多,高达育龄夫妇的10%,全国大约有一千万对育龄夫妇存在不孕不育问题,渐渐成为一个严重的社会问题,此外,随着现代化进程的推进,头胎生育年龄逐渐增加,这个问题也会日益严重。不孕不育和遗传疾病不仅为患者个人带来了巨大的痛苦,也大大增加了家庭、社会与政府的负担。
MALBAC宝宝的诞生
世界上第一个试管婴儿诞生于1978年,迄今已有超过600万个孩子是通过试管婴儿技术出生的。Robert Edwards是试管婴儿的创始人,他于2013年去世了。然而直到他去世前两年,也就是2010年才荣获诺贝尔奖,并获得爵士封号。可以想象他当年的研究工作困难有多大,绝不仅仅是技术上的困难。
中国第一个试管婴儿于1988年在北医三院诞生,由张丽珠教授完成,她是现在北医三院院长、著名妇产科医生乔杰教授的导师。当时张教授比Edwards晚了10年,而这次乔杰院长走在了世界的前列。为了将单细胞基因组学在生殖医学中进行应用,我和乔杰院长、汤富酬教授,还有亿康基因公司展开合作。汤富酬是北京大学“生物动态光学成像中心”(BIOPIC)的一位年轻有为的科学家,BIOPIC成立于2010 年,致力于技术推动生物医学的研究。作为BIOPIC的主任,在过去的几年里,我不断往返于北大和哈佛之间。我们的合作是怎么开始的呢?我当时需要一份精子活力的报告,找到乔院长帮忙,乔院长了解我们的技术以后,就说你可别光研究精子,一定要研究卵子,因为研究女人要比研究男人有意思得多。2010年,我们的“北京大学生物动态光学成像中心”(BIOPIC)成立了,立志于用技术推动生物医学的研究。
我们要做的实验是对单个人卵细胞进行高精度的全基因组测序分析。下图是一个卵母细胞,里面有两根DNA是从父亲来的,两根DNA是从母亲来的。刚才讲过,基因在重组时的交结点不一样,使得每个卵子和精子都不同。卵母细胞成熟过程中,会在旁边产生一个第一极体和第二极体作为卵细胞减数分裂的产物,它们分别是双倍体和单倍体,这两个极体细胞是没有用的,会在生殖细胞发育过程中被降解。我们为了不影响受精卵正常发育,所以选择分析两个极体细胞的全基因组来推断这个受精卵的全基因组是否正常。
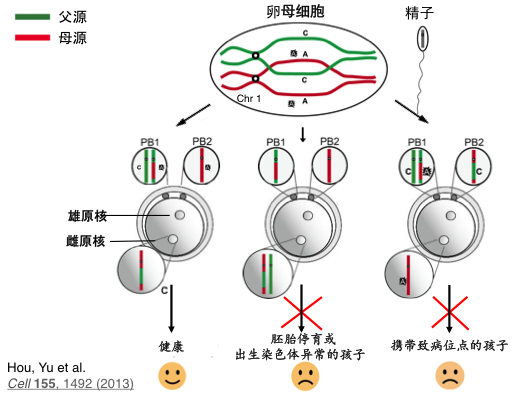
不正常的第一种情况是染色体拷贝数不正常。 原因是细胞分裂时染色体分裂异常,即使父母完全健康。这种染色体不正常会导致生殖障碍或者唐氏综合症等遗传疾病。
还有一种情况,如果父亲或母亲的基因有点突变,导致严重的遗传疾病,它们也会传给下一代。如果发生突变的基因只在极体内,受精卵没有点突变,那就没事;如果传到了受精卵里,就会让下一代患上遗传疾病。
用MALBAC技术来进行单细胞基因组扩增,我们可以同时检测并避免上述两种情况,来提高生殖细胞健康发育的成功率,避免遗传疾病发生。具体做法就是用激光打一个小洞,把毛细血管插进去,吸出两个极体细胞来测序。如果疾病遗传自母亲, 我们用这个办法。如果疾病遗传自父亲,我们则在受精第5天时取1—3个囊胚细胞来测序。
2013年,乔院长在北医三院开始了临床实验,利用MALBAC技术进行胚胎遗传诊断。我们第一个病例,是一位患有遗传性多发性软骨瘤(HME)的男性患者,他从10岁开始,几乎每过两三年就长一个瘤子,所以他的身上充满了金属。这种病是由于名为EXT2的基因发生单碱基杂合缺失,造成移码突变。与孟德尔推测豌豆遗传类似,他和正常女性生育的后代会有50%的概率患病。与豌豆实验不同的是,这是人命关天的事,不能出任何差错,所以我们特别需要MALBAC技术的精确性。
通过体外受精技术,共得到这对夫妇的18个胚胎,经过致病突变位点检测和染色体筛查,发现共有7个胚胎是既没有点突变,也没有染色体异常的,乔院长从中选了第4号胚胎进行移植。
2014年9月19日,世界首例MALBAC婴儿诞生了,我们去看这个孩子的时候,她真是完美,她一声都没哭,一直冲我笑。

第二个病例是一位携带少汗型外胚层发育不良致病突变基因的女性,她和丈夫已经有了一个遗传了这种疾病的儿子,没头发、没汗腺、没牙齿,他们想要二胎生一个正常的孩子。此病的发病率是十万分之一,美国电影演员迈克尔•贝瑞曼(Michael Berryman)也患有这种病,他没有毛发、汗腺和指甲,一直在呼吁医学界对他这种遗传病进行研究。这个致病基因EDA1是在X染色体上,如果生男孩,患病的概率是1/2,如果生女孩不会发病,因为女孩有两个X染色体,而致病基因EDA1是个隐性基因,但该女孩有1/2的概率携带这种致病基因。
通过试管婴儿技术,共得到这对夫妇的5个胚胎,其中2个胚胎既不携带致病基因,也没有染色体异常,乔院长选了一个看上去最健康的移植。这个孩子于2014年11月30日出生,不但正常而且肯定不再会把该疾病传给后代。
总结一下,MALBAC技术可以同时避免染色体不正常和非常严重的基因点突变导致的遗传疾病,使得我们可以提高生殖的成功率,得到健康的后代。
想要孩子的朋友可能会想,我们能不能用这种技术来选择一个胚胎,让孩子拥有更漂亮更聪明的基因?首先,基因组学还没有发展到这种程度,能够让我们非常了解哪个基因是控制长相的,哪个基因是控制聪明程度的。那不是单基因的问题,而是多基因的事情。我们现在做的,就是避免非常严重的遗传疾病。目前世界上大概有7000多种单基因遗传疾病,常见的有400多种。避免这类遗传疾病在伦理上是可以接受的。
能否在更广泛的情况下使用这类技术?比如是否应该筛选掉得癌几率高的BRAC1 基因,它导致癌症的几率是70%, 而不是100%, 我们能不能让父母决定婴儿以后的命运?我认为这不是我们科学家或者医生能解决的问题,整个社会应该进行伦理上的研究和讨论。
MALBAC的第二个应用是癌症。在中国,癌症的发病率、死亡率逐年上升。根据2012年的统计数据,中国每年新发癌症病例约为312万例,中国人一生患癌概率高达22%,死于癌症的概率为13%。
癌症是由于基因组改变所引起的疾病,针对癌症的很多重大课题都需要单细胞基因组学。首先是个体化治疗,即靶向治疗,就是要对症下药,通过测序找到基因组哪里出现了改变,现在很多新药都是靶向治疗。
癌症难以治愈和高死亡率的罪魁祸首是肿瘤的转移。其机理是癌症先出现在原发灶,然后通过血液循环扩散到身体的其他器官。然而,癌症病人血液中肿瘤细胞数量很少,一般只有几个,传统的研究手段往往基于大量细胞才能进行分析。因此我们的单细胞测序技术就可以用到循环肿瘤细胞的研究上。对病人来说,还有个好处就是抽血分析的检查是无创的,不用做活检。北大肿瘤医院的王洁教授、BIOPIC的白凡教授,以及天津医科大学的张宁等教授和我的实验室一起参与了这项工作。
我们在一个肺癌病人的几毫升血液样本中共找了8个循环肿瘤细胞,对它们进行基因测序,看到基因组不同位置点突变,这突变信息为个性化治疗提供了重要依据。但是,这8个循环肿瘤细胞的单碱基突变存在异质性——也就是说每个细胞都不一样,这样对癌症检测意义不大。
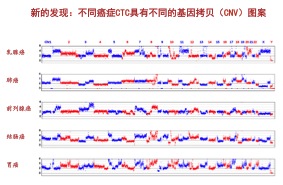
我们同时也看到拷贝数的变化。正常体细胞里的基因拷贝数是2,癌细胞要高于或低于2。实验发现同一个肺癌病人的8个循环肿瘤细胞表现出高度一致的拷贝数变异模式。更有趣的是,不同病人的同种癌的基因拷贝数图案也是一样的,这就展现了一个好的前景。我们可以通过分析循环肿瘤细胞拷贝数图案来推测癌症类型。最近我们跟张宁教授合作,又发现乳腺癌、肺癌、前列腺癌、结肠癌和胃癌具有不同的基因拷贝图案(如下图)。所以,现在我们想利用这些发现做不需活检的无创癌症检查,希望能多收集一些循环肿瘤细胞,这样也许能够做到癌症的早发现。
最后总结一下今天的讲座。DNA是以单分子的形式存在于每个细胞中的。因此,基因组的变化是随机的。这也使得单细胞和单分子水平上的检测成为必需。单细胞基因组学是单分子技术与基因组学的交汇之处。在单细胞中测基因拷贝数以及单个点突变,现在不仅已成为可能,而且真正成为了一项日益重要的技术。
精准医学是个体化医学的一个新提法,最早由美国总统奥巴马提出,大家对它有各种各样的解释。这个星期我参加了一个国内精准医学专家的会议,会议给出了一个定义: 精准医学是指在大样本研究获得疾病分子机制的知识体系基础上,以生物医学,特别是组学数据为依据,根据“患者个体”在基因型、表型、环境和生活方式等各方面的特异性,应用现代遗传学、分子影像学、生物信息学和临床医学等方法与手段,制定个性化精准预防、精准诊断和精准治疗的方案。
我们和乔杰院长合作的工作是精准医学的生动案例,有什么比一个细胞更精细?比一个碱基更准确?
单分子手段使得我们能够在单个分子的层面上检测、理解并改善生命过程。作为一个做基础研究的科学家,我热爱我的研究工作。科学家都希望研究成果能够造福人类,但是基础研究成果转化为临床应用是非常不容易的。我感到自己非常幸运,有机会与乔院长的团队合作,使我们的科学工作能够为有遗传疾病的家庭带来福音,我感到由衷的高兴。
我感谢我现在哈佛和BIOPIC的团队,以前的研究生和博士后,以及我的合作者们,BIOPIC的同事们。没有他们的努力,我今天讲不出这样的故事。







