3月4日CMDE发布《医疗器械注册单元划分原则》(征求意见稿),分有源、无源医疗器械、体外诊断试剂三篇征求意见稿。小编在上周分别为大家推送了有源与无源医疗器械注册单元划分原则,因体外诊断试剂较为特殊,今日小编奉上《体外诊断产品注册单元划分原则要点解析》,希望能帮助客户简单明了理解法规内涵。
该要点解析是在征求意见稿的基础上做的解读,仅供参考。
一、总体划分
该意见稿将体外诊断试剂与体外诊断仪器分开说明注册单元划分原则,两者的基本原则如下:

二、体外诊断试剂可作为同一注册单元的情况:
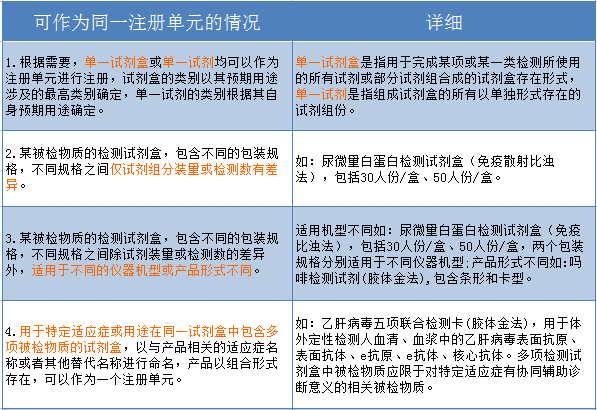

三、体外诊断仪器不可作为同一单元注册的情况:

【本文为弗锐达原创,如需转载请注明出处!违者必究】







