
12月9日,2014年最后一场百家汇名师讲坛格外精彩。中科院上海生命科学研究院副院长吴家睿谈精确医学,可以把枯燥的内容说的很生动,导致提问不断,讲座时间比预计的大大延长。提醒缺席芳邻们,以后遇到他的讲座可以多听听!
在科学高度发达的今天,人类至今还没能征服自身的一些疾病,例如肿瘤。自上世纪70年代,美国向癌症宣战,历时四十余年,花费研究资金2000多亿美元,每年发表文献150万余篇,依然没有解决这一难题。人类与肿瘤疾病的战争旷日持久,战火不停蔓延到新的领域。生命体如此复杂,以至科学研究的越深入,就越是感觉我们所知甚少,旧的认知犹如盲人摸象,始终在盯着某个局部而忽略了更重要的整体……吴教授一开场就描绘出了这样一幅场景。
当然,科学研究也在不断打开着新局面,人们开始使用全新的视角审视肿瘤等疾病,不断推翻着旧时的简单认知。这样做的结果是,肿瘤治疗变得越发复杂。
过去认为一个药物针对一个靶点,尤其是病理通路最关键的靶点,就可以扭转疾病。今日人们越发认识到,单药单靶点的机制会造成严重副作用,并且给肿瘤以极高的选择压力,导致耐药性。现在多靶点协同的问题又被热议。然而多靶点协同也并不是简单依照“治疗指南”列出的一二三线药物的随意搭配,而是应该基于系统生物学设计的多靶标策略。
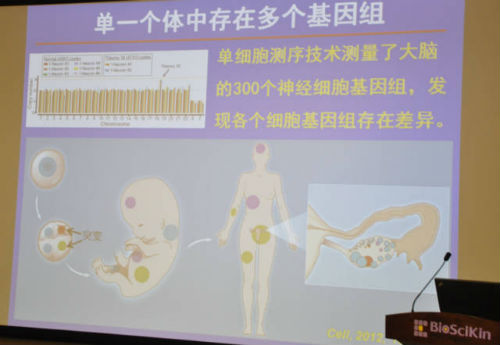
过去认为人体所有细胞享有同一个基因组,肿瘤的起源是某些单一基因突变导致,针对这个基因做文章有望攻克肿瘤。而新的研究表明,单一个体内存在不同基因组,而即使是相同的基因,也会在转录、翻译的过程中衍生出不同来源的蛋白质多态性(SAP)。

肿瘤的发生更是一个复杂的系统性改变,肿瘤细胞有大量遗传突变(有人对7000种肿瘤的检测发现了共约5百万个突变),同一肿瘤的克隆也可能具有高度异质性,肿瘤的微环境同样具有高度异质性。(吴教授自己的团队研究发现,p53基因在不同的微环境中可表现出对肿瘤或抑制或促进的不同效果)。
没有两朵花完全相同,面对复杂性疾病从基因组到转录组,再到蛋白质组个体差异的复杂情形,更不能简单以单一机制来解释,或用单一靶点来治疗。科学界衍生出基于系统生物学的“精确医学”概念,便是从整体角度研究生命体和复杂疾病,以“干试验”(理论层面的数学建模、计算科学)配合“湿实验(实验室层面的分子生物学、组学)”,整合各种生物分子数据(从基因组、转录组到蛋白质组以及代谢物组),形成全新的知识网络和疾病分类体系,从而试图找到更好的治疗手段。

有人做了以下尝试:连续一年多定期不断抽自己的血,进行全套组学研究,再配合体检结果进行整合分析,总结出一些机体的动态表达模式以及通路,2012年于Cell杂志发文。 这只是开始。理想中的精确医学可以描绘出人体生理病理尽可能详尽的通路网络,通过设计基于系统生物学的生物标记物空间坐标,做到疾病的精确诊断和合理治疗。

当前的主流医学还处于循证医学阶段——以大样本检测、数理统计取中位数比较来确定一个治疗手段是否有效。然而医学不是少数服从多数的选举,对被循证医学忽略的少数派,即那些对药物无反应的患者而言,他的无效率是100%。精确医学的发展,将可能在未来真正照顾到个体差异,得到更好的治理效果。
医学和其他科学一样,总是在随着人们的认识的提高,不断经历从简单到复杂,再从复杂到精确的螺旋式上升。尽管目前,精确医学还只是一个模糊的方向,但它也是被很多人看好的大方向和未来趋势。







