帕金森病(PD)是中老年人群常见的缓慢发病的神经系统变性疾病,以运动减少、肌张力强直、震颤和姿势步态异常为病症。全世界65岁以上老年人有1%患病,80岁患病率增加5倍。中国发病更高,现有200万病人,年增10万新病人。
北京大学分子医学研究所周专实验室报道,将人源的神经干细胞移植到PD动物模型的大脑纹状体,减轻患病大鼠的运动功能障碍, 这种改善的机制是来源于移植细胞直接释放的多巴胺(DA)神经递质。该工作于10月20日在线发表于美国国家科学院学报(PNAS)。
病变导致中脑多巴胺神经元的丢失和相应大脑纹状体DA的减少是PD的一种典型病理特征。
1990年《新英格兰医学杂志》报道, 将人源胚胎DA神经元干细胞移植到病人纹状体成功实现PD的治疗。但是这种策略遇到胚胎伦理问题无法推广。
2011年起美国加州大学张康、丁盛等应用小分子成功诱导人源干细胞定向分化成为DA神经干细胞并实现在体外大规模增殖,点燃了对应用“DA干细胞”治疗PD的期待。
但是,在科学上必须首先解决两个基本问题,一是移植的DA干细胞到体内能有治疗效果吗?二是移植的干细胞能够在纹状体分泌DA吗?
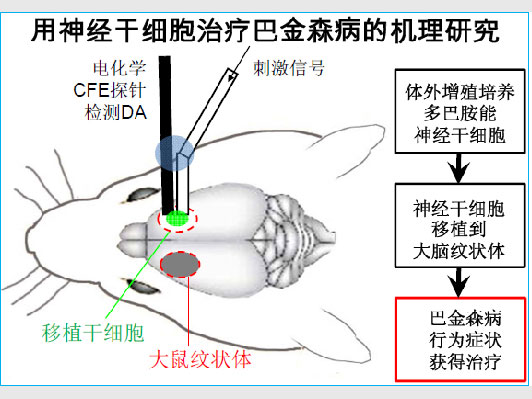
周专组首次联合两种在体(in vivo)检测技术,实现原位鉴定和记录DA分泌信号。
一是基于在体微透析的高效液相色谱大鼠大脑纹状体HPLC技术, 以原位定性分析DA分泌; 二是电化学微碳纤维电极技术, 以原位定量实时记录DA分泌。 结果证明移植人源DA干细胞16周后动物PD行为改善,与此前报道一致。
更为重要的是,他们首次证明此时的DA干细胞直接分泌DA。这项转化医学的突破性进展应用了周专1994年发明、20年来不断改良的电化学低噪音微碳纤维电极技术,为今后的其他干细胞治疗机理研究提供了在体验证干细胞功能的范例。
本项研究在周专实验室完成。体外分化、增殖人源DA干细胞由美国加州大学张康、第二军医大学李文林合作完成。第一作者康新江是分子医学研究所博士研究生。受到科技部973和基金委项目、北大-清华联合生命中心、生物膜国家重点实验室、麦戈文脑研究所资助。本文是对周专的博士生康新江的采访。
记者:这项研究起初的目的?
康新江:帕金森病是一种渐进性的神经退行性疾病,65岁以上的老年人患病率高达1%。干细胞的出现为帕金森病的治疗提供了光明的前景,但是干细胞治疗的机制仍有争议。所以我们想揭开干细胞治疗的机制。
记者:此研究最重要的发现?
康新江:我们工作重要的发现就是发现移植的干细胞自身能够释放多巴胺,释放的多巴胺导致帕金森病动物模型的运动症状的改善。
记者:这发现让人吃惊吗?
康新江:干细胞移植后,多巴胺的来源仍有争议。有人认为移植的细胞自身能够释放多巴胺,导致行为学的改善。另外有人认为是残存的多巴胺神经末梢在移植干细胞的营养作用下起死回生,多巴胺是其释放出来的。我们的结果解决了这种争议,那就是移植的干细胞自身释放了多巴胺,导致行为学的改善。
记者:您的发现的潜在的影响?
康新江:这种细胞的移植能够改善帕金森病的运动症状,为临床转化提供了基础。
记者:您下一步的研究课题?
康新江:关于干细胞的下一步研究是提高移植细胞的生存率,以取得更好的行为学改善效果。
作者介绍
康新江,理学博士, 2014年毕业于北京大学分子医学研究所 (导师 周专教授)。研究帕金森病的发病机制和帕金森病的干细胞治疗,以及在体心脏的交感神经释放儿茶酚胺问题。特长是联合微透析-HPLC和电化学微碳纤电极记录技术,从而实现定性和定量鉴定、记录单胺类神经递质在中枢或外周组织中的释放—这是一项真正的生理科学的高难度实验技术。







