在细胞中,DNA被打包压缩成染色体的形式,在极小的空间内存储着海量的遗传信息。然而近年来,研究人员发现还有一类游离在染色体基因组之外的DNA(extrachromosomal DNA,ecDNA)。这类DNA通常以环状的形式存在,不仅携带有致癌基因,还普遍存在于许多类型的人类肿瘤中。
ecDNA在肿瘤中的表现可谓是恶行累累。由于ecDNA中染色质结构更加松散,所携带的不仅有完整的致癌基因,还在基因上游携带有启动子和增强子序列,这使得ecDNA的转录活性更高,促进了癌基因的扩增。另一方面,ecDNA由于缺少着丝粒元件,因此无法通过有丝分裂均匀地分配到子代细胞中,这使得肿瘤内细胞的异质性增强,进而加速肿瘤的进化,使之更容易适应环境,产生耐药性。此外,ecDNA还能四处游走,与整个基因组发生接触,促进细胞基因的重组。
人们一般认为,正常组织中不会有ecDNA的存在。然而,近日,一篇发表于Nature上的文章Extrachromosomal DNA in the cancerous transformation of Barrett’s oesophagus指出,ecDNA在尚未癌变的组织中就已经出现,这表明它的作用可能比以往认为的更为可怕,能在癌细胞出现之前驱使组织走向癌变。

图1 研究成果(图源:[1])
在研究中,研究人员对来自英国和美国的两组巴雷特食管(Barrett's oesophagus)患者及食管腺癌(oesophageal adenocarcinoma,EAC)患者的全基因组测序数据进行了分析。由于巴雷特食管患者通常会接受频繁的活检,这使得研究人员能够收集到癌症发生前的组织样本。
巴雷特食管常发生于胃食管反流病患者的身上,随着胃酸和酶经常反流回食管,造成的慢性损伤会使得一部分人的食管内壁细胞发生变化。在少数巴雷特食管患者身上,随着食管内壁细胞获得越来越多的遗传异常和结构改变,从低度异型增生(dysplasia)发展为癌变前的高度异型增生状态。在这一过程中,某些具有肿瘤抑制功能的基因会发生突变或缺失,进而导致全基因组复制、基因组的不稳定性或灾难性的染色体重排,最终发展成食管腺癌。ecDNA也在这一过程中出现于变化的细胞内。
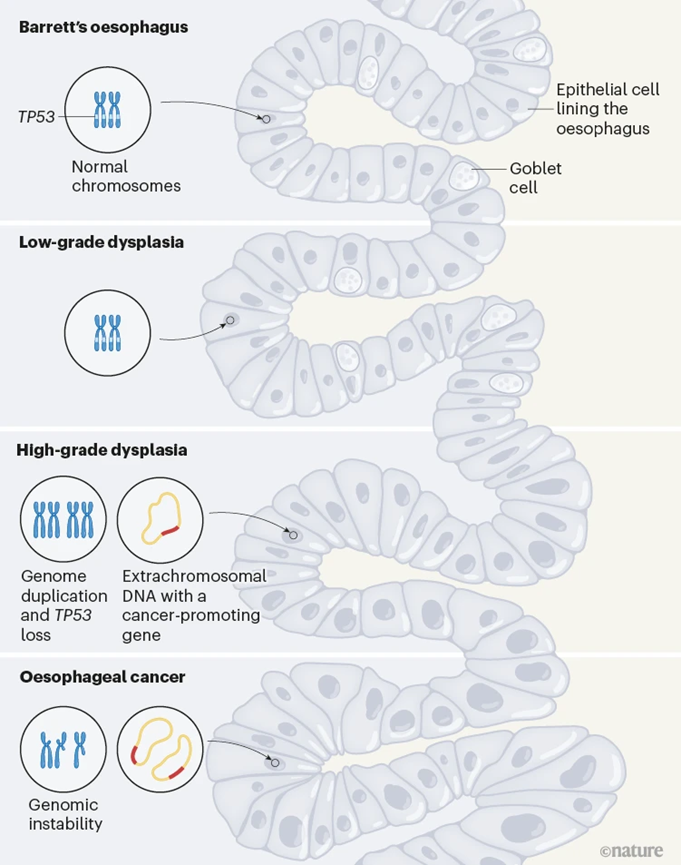
图2 巴雷特食管逐渐发展成食管腺癌(图源:[4])
研究人员试图探明,这些与疾病进展一同出现的ecDNA究竟是基因组不稳定的产物,还是导致异型增生最终跌下癌症悬崖的推手。
结果发现,在来自英国的患者组中,那些处于巴雷特食管阶段和巴雷特食管低度异型增生阶段的患者,都没有检测到ecDNA。相比之下,高度异型增生阶段、癌症早期阶段、癌症晚期阶段的患者,分别有4%、25%、43%的患者有检测到ecDNA。这说明ecDNA在癌变前的高度异型增生阶段就一出现,且随着癌症发展,情况会变得越来越严重。
对于来自美国的患者组,研究人员开展了持续数年的追踪,在不同的时间点上对他们进行样本活检。结果显示,在那些最终发展为癌症的患者中,20%的患者在癌症诊断前就发现了ecDNA,而在没有发展为癌症的患者中,发现ecDNA的比例仅为2.5%。另外,对于10名未检测到ecDNA的患者进行长期随访发现,将近10年后,他们仍未演变为高度异型增生或食管腺癌。这说明,ecDNA的存在与食管腺癌的发展关系密切。
此外,研究人员还发现,ecDNA虽然出现于知名肿瘤抑制基因TP53发生突变后,但ecDNA的出现可独立于全基因组复制或染色体碎裂的发生,即后者不是ecDNA的形成机制。当显微镜下观察到细胞的组织学异常更多时,ecDNA的结构复杂性和拷贝数也会更高。31%的人检测到不止一种ecDNA,三分之一的ecDNA包含不止一种致癌基因,其中还包含一些免疫调节基因。这些都表明ecDNA在巴雷特食管向癌症的转化中具有推动作用。
研究中还发现一例极具代表性的个例:这位美国的患者在7年时间里接受了四次活检。起初,该患者处于高度异型增生阶段,TP53确实,但没有检测到ecDNA。5年后,仍然是高度异型增生阶段,但出现了单一类型的ecDNA。六个月后,此人患上癌症,且检测到第二种ecDNA。研究人员分析了切除的肿瘤发现,肿瘤中包含两种ecDNA,然而残留的高度异型增生仅含有第一种ecDNA。这使得研究人员得出结论,即第二种ecDNA导致了异型增生向癌症的转变。
虽然这项研究主要基于临床观察,但研究中所纳入的大量个体使得该观察覆盖了从巴雷特食管到癌症的整个进展过程。研究明确了ecDNA确实可以出现在癌前组织中并使这些组织更易发生癌变,这提示ecDNA可以作为早期干预或治疗的靶点开发相关的疗法。
研究的资深作者、斯坦福大学病理学教授Paul Mischel表示:“过去,研究人员经常对肿瘤的多个部分进行DNA测序,并绘制出进化树来分析哪些突变是关键的驱动事件,哪些是发生在肿瘤发展后期的分支事件。但是由于ecDNA会在子代细胞中随机分配,在进化树上表现得更像晚期事件,导致人们错误地认为ecDNA并不是一个治疗的好靶点。但我们的研究发现,这种理解是错误的。”
未来,研究团队将进一步探究如何提高检测ecDNA的能力,是否有办法可以阻止ecDNA的形成或活动,ecDNA如何影响免疫系统,以及围绕ecDNA能否开发出新的疗法。
参考资料:
[1]Luebeck, J., Ng, A.W.T., Galipeau, P.C. et al. Extrachromosomal DNA in the cancerous transformation of Barrett’s oesophagus. Nature 616, 798–805 (2023). https://doi-org-443--bjmu.tongyongbei.com/10.1038/s41586-023-05937-5
[2]http://www.cloud-seq.com.cn/article-item-364.html
[3]Zhu Y, Gujar AD, Wong CH, et al. Oncogenic extrachromosomal DNA functions as mobile enhancers to globally amplify chromosomal transcription. Cancer Cell. 2021 May 10;39(5):694-707.e7. doi: 10.1016/j.ccell.2021.03.006.
[4]https://www.nature.com/articles/d41586-023-00982-6
[5]https://med.stanford.edu/news/all-news/2023/04/ecDNA-cancer.html





