导语:回顾风起云涌的全球药物市场大事记,每逢“重磅炸弹”出现,其惊人的销售业绩都会将持有者药企带上一个新的高度,因而这些药企也会千方百计地去维护 “重磅炸弹”的“江湖地位”。但一款药品的生命周期总是有限的,2023年,一代“药王”修美乐的众多生物类似药即将上市,未来局势又将如何变幻?
修美乐的前世今生
2002年底上市,第一年销售额就达到2.8亿美元,随后销售额持续攀升,并从2012年起连续9年蝉联药王宝座,在2021年销售额更是达到207亿美元,突破200亿美元大关,20年间为生产商创造近2000亿美元的收入,更伴随着艾伯维成长为药企巨头,这就是“药王”修美乐的傲人战绩。
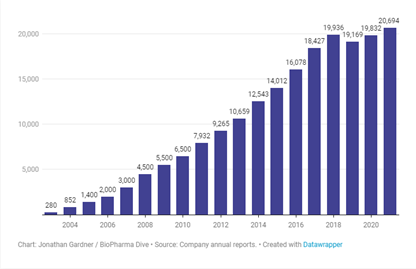
图1 修美乐历年销售额(图源:BioPharma Dive)
修美乐(Humira)是生物药阿达木单抗(adalimumab)的商品名,其命名源自于类风湿关节炎人类单克隆抗体(HUman Monoclonal Antibody In Rheumatoid Arthritis)的缩写,而类风湿关节炎也是其获批的第一个适应症。
尽管艾伯维因修美乐赚得盆满钵满,但修美乐却并非诞生自艾伯维之手,也并非来自于艾伯维的前身雅培(Abbott Laboratories)。
20世纪80年代,澳大利亚免疫学家Marc Feldmann教授基于自己先前提出的细胞因子激发自身免疫疾病的假说,与英国风湿病学专家Ravinder Maini爵士一起,寻找导致类风湿性关节炎中的关键细胞因子。结果发现,TNF-α就是那个关键的细胞因子,阻断TNF-α就可以明显缓解炎症反应。后续的动物实验也表明,向关节炎小鼠注射TNF-α抗体能够改善关节肿胀和损伤。
但是,不论是来源于小鼠的抗体还是嵌合抗体都在人体内会引起免疫反应,必须要将抗体改造为更高程度的人源化才能真正治疗人类患者。恰在1985年,美国生物学家George P. Smith教授开创了“噬菌体展示”技术,能够使得抗体人源化的任务更好地完成。英国生物化学家Gregory Paul Winter爵士则将这项技术运用于新药的开发。两人也因此分享了2018年的诺贝尔化学奖。
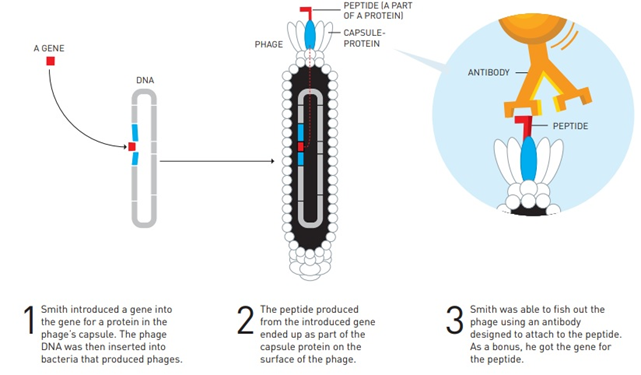
图2 噬菌体展示技术原理(图源:Nobelprize.org)
1989年,Winter爵士成立了英国剑桥抗体技术公司(Cambridge Antibody Technology,CAT),致力于对TNF-α动物抗体的改造。经过不懈努力,研究人员得到了一种完全人源化的抗体药物D2E7,即后来的修美乐。90年代末,德国著名药企巴斯夫旗下生物研究公司诺尔药业(BASF Knoll Pharma)与CAT合作开发,进一步完善了D2E7并完成了前期的生产工艺开发和临床申报。
然而,巴斯夫对研发新药缺乏兴趣,准备剥离诺尔药业,而雅培在这时正急于寻找新药以维持其收入,最终在2000年以69亿美元的高价购下诺尔药业,接手了D2E7后续的临床和上市申报,并在2002年底获得FDA批准。
立于不败之地
尽管不是第一个进入市场的TNF-α抗体药物,修美乐却因其优越的给药方案和更高的耐受性成为了同类最佳药物。2006年Humira Pen的获批更是提供了一种更为方便的自我注射方式。
获批上市后,雅培继续加大临床研究投入。得益于此,修美乐的适应症不断增加,而每一次适应症的扩充都会带来患者群的扩大和销售额的增长。2005年,修美乐被批准用于银屑病关节炎和早期类风湿性关节炎。2006年,获得了治疗强直性脊柱炎的批准。克罗恩病适应症于2007年在美国与欧盟获批。日本于2008年批准其用于类风湿性关节炎,2009年批准用于斑块状银屑病。2012年欧盟批准治疗溃疡性结肠炎。2013年,艾伯维从雅培独立出来之后,也仍在对新疾病进行临床试验并向监管申请批准。至今,修美乐已获批十多种适应症,堪称“制药界的瑞士军刀”。
在营销方面,艾伯维也舍得投入大手笔。2016年修美乐仅在电视广告上就花费了3.44亿美元,位居榜单第一。高昂的费用换来的是修美乐广告在2016年全国播出超过69000次,即全年每天每小时都有8则电视广告播放。不仅如此,长期临床试验的研究也向患者传达了其在更长时间内具备安全性和有效性的信息,促使更多潜在客户转化。
另一方面,像许多其他药企一样,艾伯维为了捍卫修美乐在市场中的王者地位,充分利用美国的专利保护制度,围绕修美乐提交了大约250项专利申请,并获得了其中130多项的授权。这些“专利丛林”涵盖了化合物、制剂、制备工艺、适应症、使用方法等多个方面,尽管化合物本身的专利于2016年就已经在美国失去保护,但其他的这些大大小小的专利使得后来的仿制者们必须绞尽脑汁“绕道而行”,或者只能等待它们在2022至2034年间到期。而且生物制剂复杂的生产过程也使得生物类似药若想要达到和原研药一致的有效性和安全性将面临更多的挑战。
即便修美乐的生物类似药还是接踵而来,“专利丛林”使得艾伯维在美国游刃有余。通过谈判、诉讼等多种方式,先后与安进、三星Bioepis、迈兰、山德士、费森尤斯卡比、Momenta、辉瑞、Coherus BioSciences、勃林格殷格翰、Alvotech等10家公司达成协议,将这些公司的阿达木单抗生物类似药在美国的上市时间推迟到2023年。
后来者们
但时间最终还是来到了2023。
2018年后的欧洲市场,修美乐失去专利保护,其市场份额很快遭到多款生物类似药的蚕食,艾伯维也采取了在欧洲降价80%的策略应对市场危机。在中国市场,同样因为专利到期生物类似药上市,艾伯维不得不在2019年主动调低修美乐的价格,换取进入医保的资格。那么2023年后的美国市场,是否将重蹈覆辙?而随着修美乐在美国市场销售额的占比逐年增加,美国市场对于修美乐以及艾伯维的重要性不言而喻。
不过西北医学消化健康中心医学主任、医学博士Stephen B. Hanauer认为,生物类似药的到来不会立刻产生影响:“有商业保险的患者每月为修美乐支付大约5美元,无法想象生物类似药如何与之竞争。”但对于那些没有保险的人来说,修美乐的每月自付费用高达7000美元。
或许是预见到失去的不可避免,艾伯维积极推出IL-23 p19单抗Skyrizi(瑞莎珠单抗)和JAK抑制剂Rinvoq(乌帕替尼)企图接班修美乐,电视广告上的投入也开始向这两个药物倾斜。管理层更自信两款药物的总销售额将在2025年达到150亿美元,未来还将超越修美乐的200亿美元年销售额纪录。然而瑞莎珠单抗正面临着同类产品的激烈竞争,而乌帕替尼则存在着安全性问题。
而在一众摩拳擦掌准备上市的生物类似药中,勃林格殷格翰的Cyltezo更是首个被批准的阿达木单抗可互换生物类似药。这意味着不必改变处方,Cyltezo就可以替代修美乐。不过对于患者而言,未必能清楚地了解可互换性的概念,出售方式和用药方式可能会更多地影响药品的定价和销售,修美乐仍然具备患者自行从药房取药的优势,而其他生物类似药则需要在门诊环境中开出。
表1 FDA批准的修美乐生物类似药
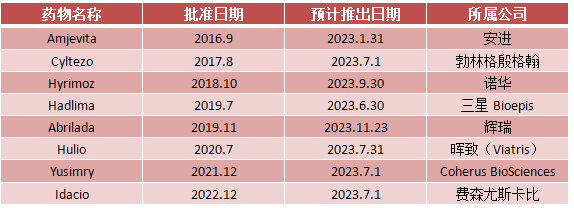
资料来源:FDA丨制表:生物探索团队编辑团队
不过,不论这场群雄逐鹿是何种结局,全球药物市场将永远不会缺乏精彩的故事。
参考资料:
[1]https://zhuanlan.zhihu.com/p/56001608
[2]https://www.linkedin.com/pulse/story-humira-swiss-army-knife-pharmaceutical-drugs-tuhin-a-rahman
[3]https://www.healio.com/news/rheumatology/20221208/hoping-for-a-biosimilar-sea-change-rheumatologists-weigh-2023-end-of-humira-exclusivity





