本文转载自“泰格医药”微信公众号。
导语:中国自药品审评审批制度改革以来,在与国际理念接轨的系列新政指引下,医药创新不断提速,监管的国际化,也成为了全球各主要监管机构的共识。
2022年6月19日至23日,由药物信息协会(Drug Information Association, DIA)主办的DIA全球年会在芝加哥隆重举行。密歇根湖南畔,来自全球监管、学术界、工业界的专家学者齐聚一堂,秉持“国际创新化、监管科学化”的初心,推动生命科学领域的深入交流和共识凝聚。

图1 DIA 2022 全球年会(图源:[2])
作为一个全球化的跨学科国际性学术组织,DIA以其特有的“中立性”优势区别于其他协会。多年来,多国国家药监相关部门通过DIA大会平台,将本国最新的监管实践与业界分享,就目前最新监管科学动态互换经验,共促成长。在本届DIA大会中,来自美国FDA、欧洲药品管理局(European Medicines Agency,EMA)、日本药品医疗器械管理局(Pharmaceuticals and Medical Devices Agency,PMDA)等官方药监机构也纷纷对药品监管国际化趋势发表了见解。
图2 DIA大会亮点(图源:[2])
Robyn Bent:FDA始终践行“把患者放在首位”的理念
作为DIA会议的举办国,美国共有53位来自FDA的专家与会发言,其中有来自FDA评审和研究中心的国际监管专家Judith Arcidiacono、CDER合规办公室主任Kassa Ayalew和CDER以患者为中心的药物开发计划主任Robyn Bent(图4)等,让更多与会者听到来自FDA高层的声音。

图3 Robyn Bent(图源:[1])
FDA一直将以患者为中心落实到实际工作中。2022年2月25日,FDA在此前基础上正式发布了《以患者为中心的药品研发:识别对患者重要的方法》的定稿指南。Robyn Bent介绍,“该指南旨在提出一系列方法和最佳研究实践,帮助患者明确那些在疾病负担、治疗负担以及在患者疾病管理中的获益和风险。”FDA鼓励利益相关者在收集与疾病和治疗负担相关的患者数据时,积极与FDA审评部门联系反馈。FDA建议利益相关者在设计和实施评估疾病和治疗负担的研究时,与患者和其他相关专家多沟通交流,如临床专家、调查方法学家、统计学家、心理测量师等人员。这个以患者为中心的药物研发思路指南,展示了不同疾病、治疗收益、使用环境分别对应的临床结局评估工具,对患者具有较大参考价值[3]。
Emer Cooke:EMA应完善新冠应对体系,助力全球早日战胜病毒
此次现身会场代表欧洲药品管理局(European Medicines Agency,EMA)发言的有9位专家,其中最受瞩目的莫过于EMA首位女局长Emer Cooke(图4)。2020年6月25日,Cooke被EMA管理委员会任命为执行董事。Cooke表示:“当我受命于被新冠病毒包围的危难之际,EMA的当务之急是完善应对新冠病毒这一类流行疾病的医疗体系,持续支持开发和批准安全有效的新冠疫苗以及治疗方法,从而联合各方力量助力人类早日战胜病毒”。对于未来,Cooke表示EMA将重点应对抗生素耐药性,推动药品创新化浪潮,促进药品与数字化的深入融合[4]。

图4 Emer Cooke(图源:[1])
Yasuhiro Fujiwara:PMDA助力抗击疫情,坚定落实4F战略
此次会议中,PMDA的首席执行官Yasuhiro Fujiwara(图5)博士也现身参会,他曾担任国立癌症中心战略规划局局长、国立癌症中心医院副院长。在会议中,Fujiwara博士指出,新冠疫情给监管部门带来了前所未有的挑战。PMDA自疫情爆发以来,主要从以下几个方向助力抗击疫情:第一,加速审批与治疗新冠病毒相关的产品。PMDA有紧急授权制度,可授权临床医生使用在药品监管系统等同于日本的国家获批、但尚未经PMDA正式批准的产品;第二,出台新冠疫苗接种指南,并发布与新冠疫情相关的23项药品安全信息、1项医疗器械安全信息、3项医疗安全信息和4项国际活动信息。PMDA承诺努力应对疫情,采取进一步措施加快新冠产品的临床开发,更及时更精准地提供日本临床试验/临床研究信息,为新冠疫苗开发提供免费的科学建议[5]。

图5 Yasuhiro Fujiwara(图源:[1])
自Fujiwara博士规划了“4F”(患者第一、可及性第一、安全性第一、亚洲第一)的亚洲战略,日本一直积极倡导和践行该理念。他强调,未来还需加强国际合作,促进全球同步开发, 快速建立国际对话。
周思源:从仿制药向创新药转型,NMPA助力中国药物研发与创新
目前,国际上药品监管领域的权威组织分别有国际药品监管机构联盟(International Conference of Drug Regulatory Authorities,ICMRA)、国际人用药品注册技术协调会(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH)和国际药品认证合作组织(Pharmaceutical Inspection Convention and Pharmaceutical Inspection Co-operation Scheme,PIC/S)。
在本次大会中,国家药品监督管理局(National Medical Products Administration,NMPA)的药品审评中心副主任、ICH工作办公室主任周思源与会并发表讲话。周主任表示,自加入ICH以来,中国在药品审评标准和指导原则体系建设上迅速与国际接轨。在政策红利的带动下,我国新药研发快速发展,新靶点、新机制的药物纷纷进入临床研发阶段,更可喜的是全球新药市场上已有我国自主研制新药的身影,国内创新药研发整体态势长期向好。
过去几十年,中国制药工业长期以发展仿制药为重心,药品审评体系的核心逻辑在于评价药学的“一致性”。但是从仿制到创新,在一个符合新药研发规律的审评标准体系中,基于临床研究证据的强度与完整性将占据主导,由此生物统计学科定量的价值在审评标准体系中的重要性显得愈发突出。在当前我们面对的由药品仿制向药物创新过渡的关键时期,加强生物统计学科的发展,引入临床研究的新工具、新方法和新标准,对于加快中国药物的创新发展,参与国际研发具有重要的意义[6]。
加入ICH五年:从参与到助力,中国药物创新逐步接轨国际
ICH工作的实质是推动审评标准的国际化。自国家药监局2017年加入ICH之后,我国药物创新国际化的步伐更加坚定,药物审评现代化也迈向了快车道。作为ICH全球化战略的重要组成部分,NMPA一方面积极推进ICH指南的落地,另一方面通过出台技术指导原则,缩小与国际指南的差距。
2017年6月,中国正式加入ICH,正式成为管委会其中一员,NMPA一直脚踏实地,积极参与ICH指南的培训、沟通和修订中;2021年,ICH宣布NMPA连任ICH管委会成员,NMPA用其默默努力与付出获得了国际认可(图6)。加入ICH5年来,国家药监部门推动我国充分实施46个ICH指导原则,借鉴国际经验深化药审改革,吸引全球创新资源加速流向中国。中国上市的创新药连续增加,2021年,我国创新药注册的受理量、审结量创近五年新高,全年审评通过47个创新药,与2020年的20个相比实现了质的跨越,使得国内患者更快更多用上全球新药。
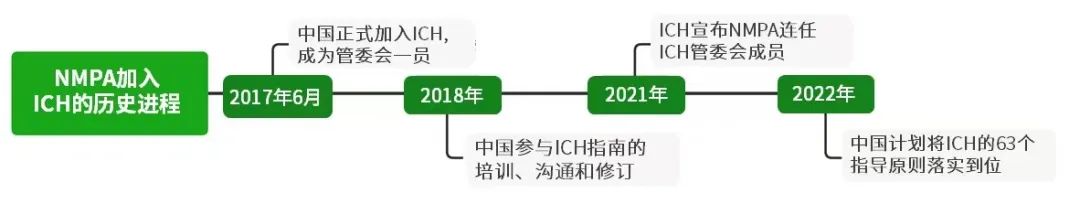
图6 NMPA加入ICH的发展进程(参考资料:[6])
ICH在中国的发展进程,也是中国药品监管快速与国际接轨的进程,是中国药品监管机构与学术界、工业界与国际的监管机构和学术界、工业界合作的过程。在这个过程中,中国药品监管与中国的学术界、工业界一起共同前行,一起经历了国际化的考验。加入ICH对推动中国乃至全球药物研发创新,深化中国药品审评审批的改革,提升中国药品监管能力,和建设国际化水平具有非常重要的意义[7]。
对此,周思源展望未来道:“我们要和国际监管机构共同面对新监管问题,并制定新指导原则,为全球药品监管贡献更多中国智慧。”

图7 来自美国、欧洲、拉丁美洲的泰格团队参展2022 DIA年会
DIA 2022会议已完美收官,包括泰格医药在内的多家中国企业也参与了本次盛会。大会期间,泰格医药也携手子公司方达医药共同举办了客户接待酒会,与嘉宾们及合作伙伴共同探讨了当前全球新药审批与监管所面临的难题与挑战,泰格也与同行学者分享了自己看法与洞见。让我们相约下一次大会,共迎未来的机遇与挑战,共同见证生物医药行业的发展!

图8 泰格医药与子公司方达医药在2022 DIA年会期间共同举办的客户接待酒会
撰文|露娜
排版|露娜
参考资料:
[1]https://www.diaglobal.org/flagship/dia-2022/program/schedule/meet-us#Meet%20the%20Keynote%20Speakers
[2]https://www.diaglobal.org/en/about-us
[3]https://cloud.tencent.com/developer/news/646490
[4]http://www.rrrry.com/art_60741.htm
[5]https://www.pmda.go.jp/about-pmda/news-release/0012.html#3
[6]http://www.pharmadj.com/cms/detail.htm?item.id=4a8ecb732deb11eb8efdfa163e227c38
[7]https://xueqiu.com/3483303916/181917026





