2021年12月15日,Evaluate Vantage发布了最新『Evaluate Vantage 2022 Preview』,预计2022年全球制药领域将有十款重磅疗法获批。2天后,安进(Amgen)和阿斯利康(AstraZeneca)联合宣布,美国食品药品监督管理局(FDA) 已批准Tezspire™(tezepelumab-ekko)用于12岁及以上患有严重哮喘的成人和儿童患者的附加维持治疗,成功赶上了2021年的上市“末班车”。Tezspire已先行上岸,那我们来盘点一下其余九款疗法的最新研究进展。
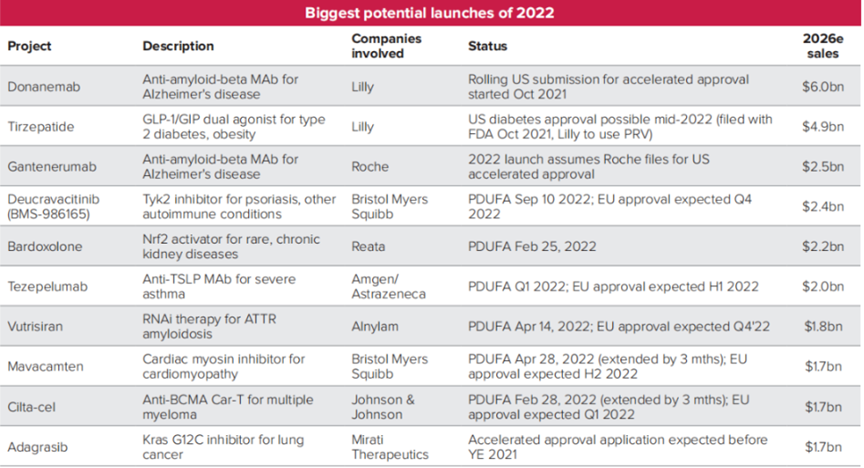
2022十大最具商业潜力待批新药(图源:Evaluate Vantage)
礼来:最佳潜力股
Donanemab是一种靶向被称为N3pG的修饰化β淀粉样蛋白斑块的在研抗体药物,在2期临床试验中达到主要终点,显著减缓了早期症状性阿尔茨海默病患者的认知和日常功能综合指标的下降,将早期阿尔茨海默病患者的临床进展速度延缓32%,因此获得FDA授予的治疗阿尔茨海默病的突破性疗法认定。目前,礼来已递交donanemab的滚动申请,寻求FDA的加速批准。
作为一种创新型药物,Tirzepatide是葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样肽-1(GLP-1)的双受体激动剂,将两种肠促胰素的作用整合到一个分子中。SURPASS-4试验达到了主要和关键次要终点,与对照组甘精胰岛素相比,所有三个剂量的Tirzepatide均实现了糖化血红蛋白和体重的显著降低。这表明Tirzepatide在降糖和减重方面的巨大潜力,可能成为2型糖尿病患者的一种重要的治疗选择。礼来已在2021年10月向FDA递交上市申请,并计划使用优先审评券。
罗氏:阿尔茨海默病疗法新浪潮
Bardoxolone是一种在研口服Nrf2激活剂。Nrf2是一种转录因子,可诱导恢复线粒体功能、减少氧化应激和抑制促炎信号的多个分子通路,促进炎症消退。Bardoxolone已被FDA授予了治疗Alport综合征和常染色体显性多囊肾病(ADPKD)的孤儿药资格(ODD);在欧盟,Bardoxolone也被授予了治疗Alport综合征的ODD。Bardoxolone目前在FALCON3期研究中评估治疗ADPKD患者、在MERLIN2期研究中评估治疗有快速进展风险的CKD患者。根据PDUFA日期,FDA有望在2022年2月25日及之前给出答复,Bardoxolone将成为第一个治疗Alport综合征的药物。
Vutrisiran是一种在研皮下给药RNAi治疗药物,用于治疗遗传性转甲状腺素蛋白淀粉样变性多发性神经病(hATTR-PN)成人患者。该研究在9个月时间点达到了主要终点和全部次要终点,最新研究达到了18个月时间点测定的全部次要终点:与RNAi药物Onpattro(patisiran)3期APOLLO研究的外部安慰剂数据相比,vutrisiran治疗使神经病变损害(mNIS+7)、生活质量(QOL)、步态速度、营养状况、总体残疾在统计学上有显著改善。Vutrisiran目前处于FDA审评阶段,PDUFA日期为2022年4月14日,有望在2022年第四季度于欧盟获批。
题图:Evaluate Vantage官网
[2]https://www.lilly.com/
[3]https://www.roche.com/
[4]https://www.bms.com/
[5]https://www.reatapharma.com/investors/events-and-presentations/event-details/2017/-Presentation-Bardoxolone-Methyl-Overview-November-2017/
[6]Alnylam Reports Positive Topline 18-Month Results from HELIOS-A Phase 3 Study of Vutrisiran in Patients with hATTR Amyloidosis with Polyneuropathy.
[7]https://www.jnj.com/new-data-from-cartitude-1-study-show-continued-deep-and-durable-responses-of-ciltacabtagene-autoleucel-cilta-cel-in-treatment-of-heavily-pretreated-patients-with-multiple-myeloma
[8]https://www.mirati.com/science/clinical-trials/





