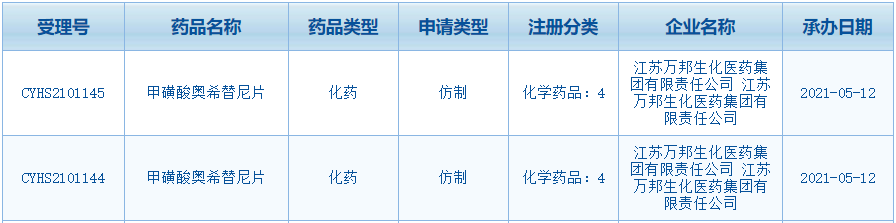
国内首个奥希替尼仿制药申报上市
根据5月12日国家药监局药审中心(CDE)官网公示,江苏万邦生化医药递交的 4 类新药甲磺酸奥希替尼片仿制药上市申请已获得受理,受理号:CYHS2101144、CYHS2101145。这是国内首个申报上市的奥希替尼仿制药。
奥希替尼为阿斯利康研发的不可逆的第三代EGFR酪氨酸激酶抑制剂,也是全球首个上市、中国首个获批的用于 EGFR T790M 突变阳性的局部晚期或转移性非小细胞肺癌的肿瘤药物,2020年全球销售额达42.4亿美元。去年12月,该产品通过续签进入新版医保乙类药品目录,在国内的价格为186元/片(80mg )。v根据 Insight 数据库,当前国内三代 EGFR-TKI 竞争日益激烈,除阿斯利康的奥希替尼、豪森的阿美替尼以及艾力斯医药的伏美替尼 3 款药物获批上市外,由艾森生物带来的艾维替尼、贝达药业的贝福替尼、石药及倍而达的瑞泽替尼均已经报产。
首款Trop-2 ADC药物国内申报上市
5月12日,云顶新耀申报的“Sacituzumab Govitecan(注射用戈沙妥组单抗)”上市申请获CDE受理并拟授予优先审评资格,用于治疗接受过至少2线既往治疗的转移性三阴性乳腺癌成人患者。
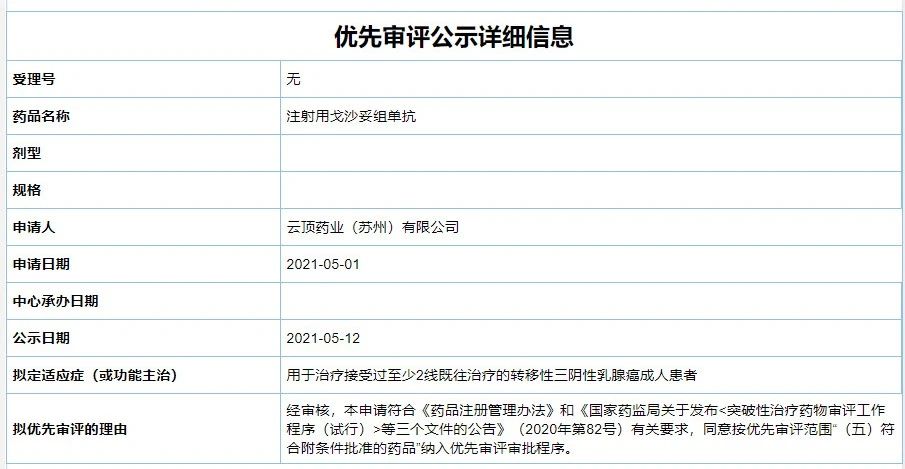
Sacituzumab Govitecan是Immunomedics公司全球首创的 ADC药物,也是首个靶向TROP-2的抗体药,于2020年4月获得美国FDA批准上市,用于治疗此前至少接受过两种治疗的转移性三阴性乳腺癌(mTNBC)患者。2019年4月,云顶新耀获得了该产品在大中华区、韩国及一些东南亚国家和地区的开发、注册和商业化权益。
截止目前,全球有11款ADC药物获批上市,但是尚无国产ADC上市。不过,荣昌生物已经向中国药监局提交了ADC药物RC48的上市申请,有望填补这一空白。
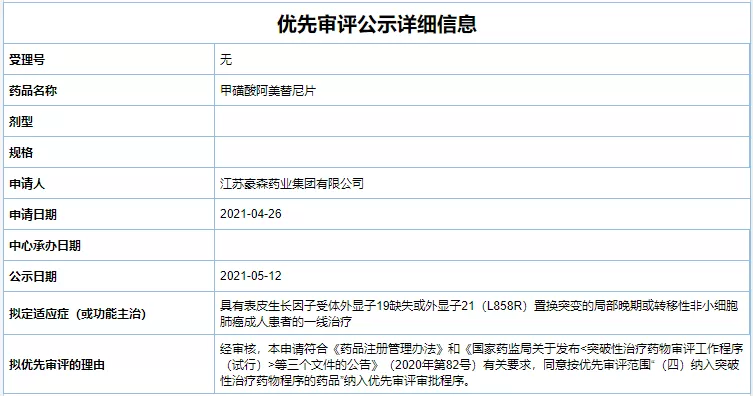
豪森药业阿美乐®新适应拟纳入优先审评
5月12日,江苏豪森药业集团有限公司自主研发的1类创新药甲磺酸阿美替尼(阿美乐®)一线治疗EGFR突变阳性局部晚期或转移性非小细胞肺癌(NSCLC)的新药上市申请被国家药品监督管理局药品审评中心纳入拟优先审评品种公示名单。这是阿美乐®第二个适应症。
阿美乐®是一种新型的、不可逆的表皮生长因子受体酪氨酸激酶抑制剂 (EGFR-TKI) ,可以选择性的抑制EGFR敏感和耐受突变。该产品为首个中国原创三代EGFR-TKI创新药,于2020年3月获批上市,用于治疗非小细胞肺癌,解决T790M耐药性难题。
东曜药业TOM218醋酸甲地孕酮口服混悬液获批上市
5月13日,东曜药业宣布,其进口代理产品醋酸甲地孕酮口服混悬液获得国家药品监督管理局(NMPA)的上市批准,用于治疗获得性免疫缺陷综合征的厌食症,以及获得性免疫缺陷综合征及癌症患者恶病质引起的体重明显减轻。这是中国大陆地区首个获批上市的高浓度醋酸甲地孕酮口服混悬液,也是唯一针对治疗恶病质明确口服剂量的药品。
醋酸甲地孕酮口服混悬液由安成国际药业股份有限公司研发,其在普通混悬剂基础上采用纳米晶体工艺,有效提高了生物利用度,每天口服5ml即可达到临床有效剂量,从而提升了患者依从性。该产品于2014年在美国获批上市,东曜药业拥有其在中国大陆、香港、澳门的独家代理权。
参考资料:
[1]各公司官方微信公众号及相关媒体报道





