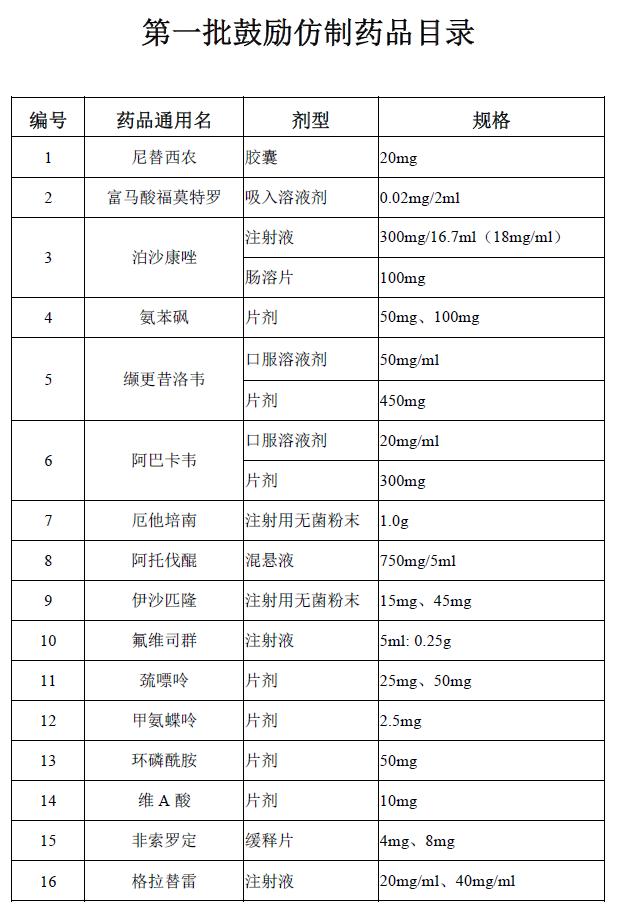
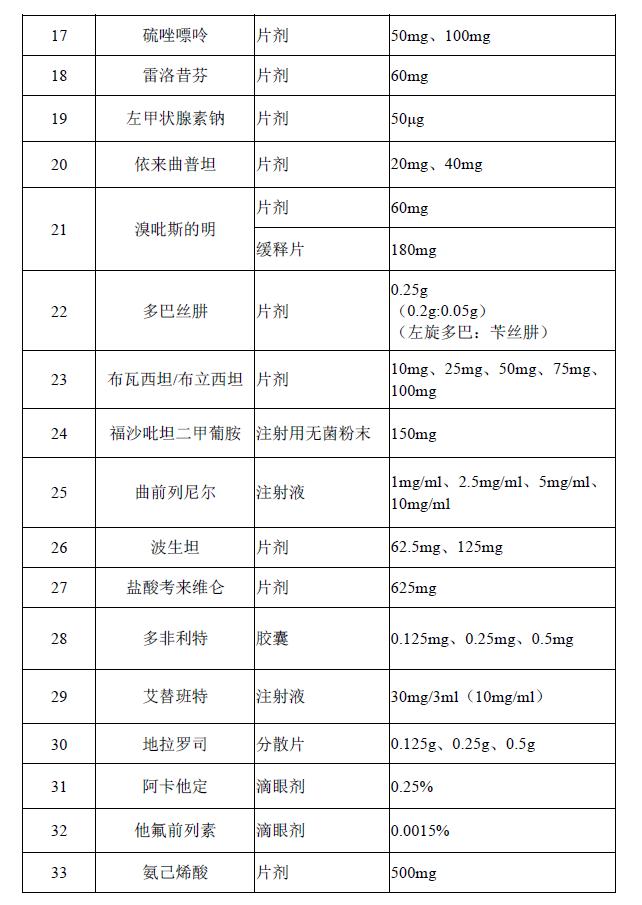
近日,国家卫生健康委印发《关于印发第一批鼓励仿制药品目录的通知》。目录共囊括了33种药品,其中以抗癌药、罕见病用药及免疫系统治疗药物为主。推进仿制药一致性评价旨在提高仿制药质量,降低药价。
中国政府网截图
值得注意的是,此次目录中罕见病治疗药物达11种,据了解, 此次鼓励药品仿制的目录中,1号尼替西农可用于治疗I型遗传性酪氨酸血症;12号甲氨蝶呤、13号环磷酰胺、17号硫唑嘌呤皆为免疫抑制剂,肿瘤、自身免疫病都会使用,涉及的罕见病有重症肌无力、白塞病、系统性硬化症(硬皮病)、多发性硬化、视神经脊髓炎等;16号格拉替雷可用于治疗多发性硬化;21号溴吡斯的明则是治疗重症肌无力的药物;青年帕金森的治疗离不开22号多巴丝肼;序号25的曲前列尼尔:特发性肺动脉高压;26号波生坦、29号艾替班特、33号氨己烯酸分别对应了特发性肺动脉高压和硬皮病、遗传性血管水肿、结节性硬化的治疗。不难看出此次罕见病药物成为今年国家重点发力对象。
目前全世界只有10%的罕见病有药可治,而几乎所有罕见病药物都是由欧美药企研发,其中只有少数药物进入中国市场。在中国,罕见病患者面临确诊难、无药可用、缺乏经济条件用药等现实问题。
虽然诺华、赛诺菲、罗氏等全球领先药物生产巨头在将一些孤儿药带进中国,但是由于特殊的海关进口管制、药物审批,流通到国内市场上的药品不仅数量减少而且价格相当昂贵。而由于罕见病群体过小,药企收益不确定,研发、临床实验等均缺乏动力。

面对这些问题上海四叶草罕见病家庭关爱中心(CORD)创始人黄如方先生有着自己独到的见解。此前在深圳举行的中国罕见病大会上,黄如方先生表示:“我们一直致力于患者组织的孵化,鼓励患者与药企合作,参与新药在中国的临床实验,这对罕见病药物未来在中国的研发和推广有重要意义。”
仿制药面临的困境
此次发布的目录无疑推动了中国罕见病治疗发展,仿制药在一定程度上打破了研发初期需要攻克的艰难壁垒。在临床上、优先审批,甚至一致性评价等方面,给予企业更多时间和成本的支持,加快罕见病药物更快更低成本进入市场。
图片来源:Pixabay
但我们也需要考虑到,一些企业并不愿意研发仿制药,这背后是多种因素相互作用影响,像是市场需求小、原料药供给难、成本投入高、仿制技术难度大等。在仿制药获得一致性评价后,药品价格如此低,带量采购又带来了很多变数,所以企业更是不愿意仿制了。现在很多企业已经暂停了之前的仿制,转战一些竞争力强的品种。
让患者参与到药物研发全过程
作为中国最大的罕见病患者组织,CORD帮助招募患者进行一些药物的临床试验。但是黄如方先生仍然表示,对于临床试验的早期设计和临床试验的终端,患者仍然处于被动地位。
在黄如方看来,患者才是药物研发的中心,患者组织能够提供专业、有效的意见和反馈,同时也带来了来自于病人的真实世界群体里面最真实的需求。

当问及患者组织可以参与到药物研发的哪些环节?黄如方的答案是“所有”。很多时候,患者只是作为被试者参与临床试验,鲜少有人问过患者的建议。马里兰大学科学创新卓越监管研究中心曾发布一套打分系统,将患者在药品研发全过程中的角色自下而上分为四个等级:被试者、反应者、顾问、合伙人。最高的等级是“合伙人”,即患者组织从临床试验的设计立项,到临床试验的终端,临床试验的过程当中招募患者,都能够充分参与。
近年来,国家越来越重视罕见病患者的生存状态,政策环境只会越来越好,相信黄如方心中让患者参与罕见病药物研发全过程能够给中国罕见病药物带来新的机遇。
据了解, 此次鼓励药品仿制的目录中,1号尼替西农可用于治疗I型遗传性酪氨酸血症;12号甲氨蝶呤、13号环磷酰胺、17号硫唑嘌呤皆为免疫抑制剂,肿瘤、自身免疫病都会使用,涉及的罕见病有重症肌无力、白塞病、系统性硬化症(硬皮病)、多发性硬化、视神经脊髓炎等;16号格拉替雷可用于治疗多发性硬化;21号溴吡斯的明则是治疗重症肌无力的药物;青年帕金森的治疗离不开22号多巴丝肼;序号25的曲前列尼尔:特发性肺动脉高压;26号波生坦、29号艾替班特、33号氨己烯酸分别对应了特发性肺动脉高压和硬皮病、遗传性血管水肿、结节性硬化的治疗。
附件