本文转载自“学术经纬”。
今日,《自然》子刊《自然·医学》上刊登了一篇关于抗癌疫苗的重磅研究论文——来自西奈山伊坎医学院的一支研究团队发现,对于连PD-1疗法都无法有效治疗的癌症,一种全新的抗癌疫苗技术能带来持久的病情缓解!

我们知道,癌症免疫疗法虽然充满治疗潜力,但也有其瓶颈所在。在黑色素瘤等最佳治疗案例中,免疫检查点抑制剂也只对20%-30%的患者生效。对于其他癌症患者来说,缓解率只有个位数。如何改善这部分患者的预后,便成了科研人员所关注的重点。
目前,研究人员们将免疫疗法不起效的原因主要归结于两点:免疫T细胞无法识别癌症特异抗原,或是T细胞在识别抗原后无法进一步对癌细胞进行杀伤。在这项研究里,科学家们指出,惰性非霍奇金淋巴瘤(iNHLs)可能成为突破口。这种血液癌症无法通过化疗治愈,免疫检查点抑制剂对其也几乎没有作用。然而,靶向癌细胞的细胞疗法却能有效对其进行杀伤。研究人员们相信,搞明白背后的差异,就有希望搞明白抗PD-1等重磅疗法不起效的原因。

▲本研究负责人Joshua Brody教授(图片来源:The Institute for Family Health)
首先,研究人员们整理了淋巴瘤细胞的一些特性。与实体肿瘤不同,B细胞淋巴瘤里的“B细胞”是一类抗原呈递细胞(APC)。顾名思义,它们能够堂而皇之地把癌症抗原展现在细胞表面,供免疫T细胞识别。
在体外实验中,这些抗原足以让幼稚T细胞(naïve TC)致敏,促进免疫反应的发生。但研究人员们发现,体外实验的结果并不能照搬到体内系统中。在体内实验里,这些癌细胞表面的抗原并不足以诱发T细胞的免疫反应。这表明想要让免疫T细胞进攻癌细胞,我们还需要其他的肿瘤相关抗原呈递方式。
在人体内,树突状细胞(DC)同样也是一类抗原呈递细胞。它们能协助诱发T细胞的免疫反应吗?为了测试这个想法,研究人员们设计了一套精妙的“原位疫苗接种”(in situ vaccination)系统。这套系统分为几个环节:研究人员们首先在肿瘤部位注射Flt3L,促进大量树突状细胞在肿瘤附近富集。随后,他们在肿瘤位点进行局部放疗,意图杀死部分癌细胞,让它们释放肿瘤相关抗原,助力树突状细胞进行更好的抗原呈递。最后,他们还引入了一种叫做聚肌胞苷酸(pIC)的分子,它能激活TLR3,进一步加强免疫反应。
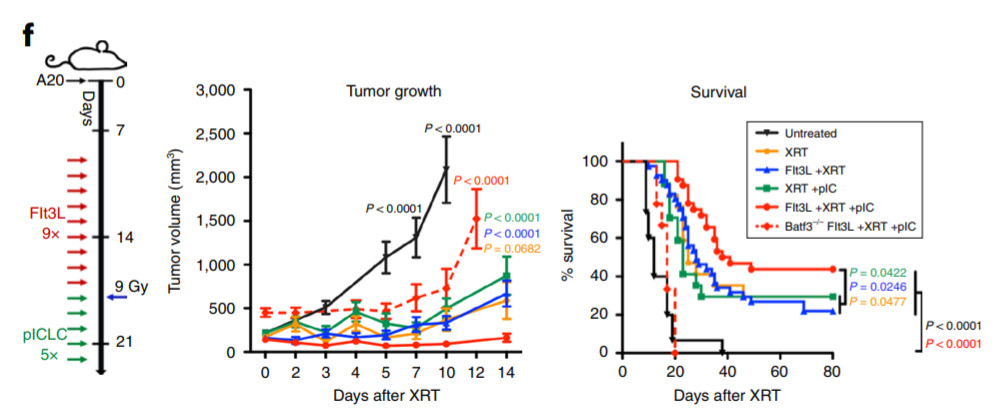
▲这套抗癌疫苗系统在小鼠模型中成功控制了肿瘤生长,也取得了良好的生存率(红色实线)(图片来源:参考资料[1])
研究人员们或许自己都没有想到,这套抗癌疫苗在接下来的实验中,彰显了令人赞叹的抗癌效果。
在动物实验中,仅仅是治疗的数天后,小鼠的肿瘤就在免疫反应的作用下,出现了快速的消退。此外,这款疫苗也带来了长效的抗癌效果:经过治疗后,有大约40%的小鼠能够以无肿瘤的状态活过3个月。而在未经治疗的对照组中,不到1个半月,所有的小鼠均告死亡。
而且,这种抗癌疫苗与抗PD-1疗法形成良好的协同作用。抗PD-1疗法的机理是松开免疫系统的刹车,让T细胞更好地攻击癌细胞。在两种具有不同机理,却又相辅相成的疗法的治疗下,得以长期存活的小鼠比例从40%猛增到80%,翻了个倍!
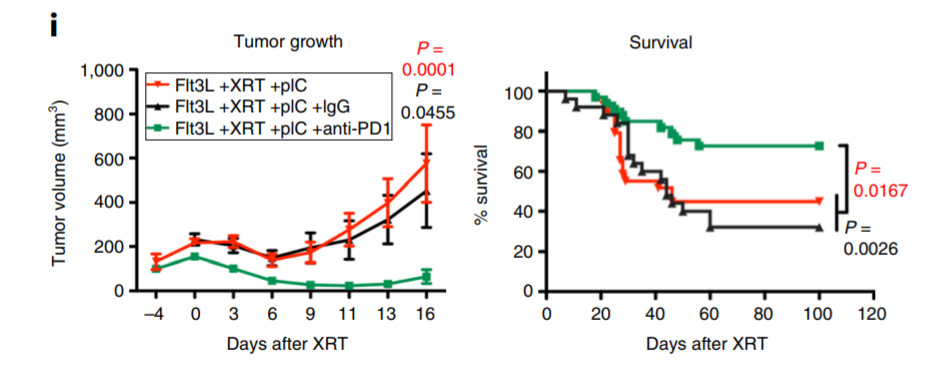
▲这套抗癌疫苗系统与抗PD-1疗法联用,能取得更好的效果(绿线)(图片来源:参考资料[1])
这款在小鼠体内展现巨大潜力的抗癌疫苗,在人类患者中的表现究竟如何呢?在一项早期临床试验中,科学家们回答了这个问题——他们招募了11名患有iNHLs的患者,从过往经验来看,针对PD-1的免疫检查点抑制剂对这些患者无效。在抗癌疫苗的治疗下,11名患者中有8名取得了病情缓解,其中完全缓解的患者有2名。1名达到完全缓解的患者,无进展生存期已经接近4年!这些积极结果,也让研究人员们充满信心,开展下一步临床试验。
值得一提的是,在那些对这种抗癌疫苗无效的患者里,体内带有PD-1的T细胞水平有所增加。这表明在抗癌疫苗的帮助下,原本无效的PD-1疗法,有望首次造福这些患者。研究人员们指出,这也为将来的临床试验提供了依据。
“原位疫苗接种的方法对多种癌症都有广泛的治疗潜力,”本研究的负责人Joshua Brody教授说道:“这一方法也有望增加免疫检查点抑制剂等免疫疗法的成功几率。”
参考资料:
[3] Mount Sinai researchers develop treatment that turns tumors into cancer vaccine factories, Retrieved April 8, 2019,







