本文转载自“药明康德”。
提到基因编辑,我们可能首先想到的是著名学者张锋和Jennifer Doudna博士共同发现的CRISPR基因编辑系统。而提到单碱基编辑系统,我们可能首先会想到Broad研究所著名科学家David Liu和张锋博士等人共同创建的Beam Therapeutics公司,这家初创公司致力于使用基于CRISPR的单碱基编辑系统,对特定DNA和RNA上的单个碱基进行编辑,它在治疗多种因为单个碱基突变导致的遗传病上具有广阔的前景。
图片来源:ProQR Therapeutics官网
不过说到对RNA序列进行单碱基编辑,你可能不知道的是,这一领域的研究早在1995年就开始了,而近年来,除了Beam Therapeutics以外,还有多家初创公司和学术界的研究人员正在开发更为简便的RNA编辑方法。而张锋博士开发的CRISPR技术,与RNA编辑领域的起起落落也有紧密的关联。今天,药明康德的微信团队将与读者分享这一领域的发展故事。
Joshua Rosenthal博士不是你想象中那样的典型生物科技创业者。这位科学家大多数时间呆在麻省伍兹霍尔海洋研究所研究乌贼的神经系统,当然有时候他也会使用章鱼。然而在2018年的四月,他来到波士顿,面对Atlas Venture的投资人们,介绍一种新的治疗模式。它是基于乌贼编辑它们信使RNA(mRNA)的生物机制。

▲Joshua Rosenthal博士和他的研究对象(图片来源:霍尔海洋研究所官网)
mRNA是由DNA转录生成的单链核苷酸序列,它们是指导蛋白成产的蓝图。Rosenthal博士告诉Altlas的投资人们,乌贼和章鱼能够非常有效地利用一种称为ADAR的酶,对它们的RNA序列进行上千次单碱基编辑。这些微小的编辑能够改变蛋白的结构和活性,帮助控制这些动物神经中的电冲动。
人类体内也存在天然的ADAR酶,它们也能够行使同样的功能,只不过效率没有那么高。Rosenthal博士对乌贼的研究激起了他利用ADAR的功能对人类RNA进行精准编辑的想法。通过使用一种称为ADAR指导RNA(guide RNA to ADAR)的RNA片段,Rosenthal实验室能够让ADAR对互补RNA链上特定位点的碱基进行编辑。这个步骤与CRISPR基因编辑非常类似,CRISPR基因编辑系统同样使用了一个指导RNA将名为Cas9的内切酶引入到互补DNA序列上。
与DNA编辑造成的永久变化不同,RNA编辑的作用是可逆的,因为细胞会不断生成新的RNA拷贝。如果Rosenthal博士的RNA编辑系统能够在人体中获得成功,它们可以被用来重复治疗特定遗传疾病,同时不需要面对CRISPR系统永久改变DNA编码需要面对的长期未知风险。更重要的是,这种治疗模式为只需要暂时治疗的疼痛或炎症患者提供了一种新的治疗策略。RNA编辑可能比CRISPR更容易转化为疗法,因为ADAR酶已经存在我们的细胞中,理论上我们只需要引入指导RNA,“套上”这些酶,然后告诉它们去哪里进行碱基编辑。
这些优点打动了Atlas的合伙人Nessan Bermingham先生,他曾经是Intellia Therapeutics公司的CEO,这是一家开发基于CRISPR疗法的公司。Atlas创建了一家名为Korro Bio的初创公司,开发基于RNA编辑的疗法。这一新兴领域正在得到更多的关注,至少有4家生物技术公司正在开发基于RNA编辑的疗法,更多学术研究实验室在试图设计新的RNA编辑器。

RNA编辑的理念并不新颖。早在1995年,Ribozyme Pharmaceuticals公司的研究人员就发现反义寡核苷酸可以募集ADAR酶到互补RNA链上进行碱基编辑。他们在《PNAS》杂志上发表了这项研究,并且提出了“治疗性RNA编辑”这一说法。然而这篇论文只被引用过一次,就被人遗忘了。
直到十多年后,Rosenthal博士和德国图宾根大学(University of Tübingen)的化学家Thorsten Stafforst博士相互独立地重新点燃开发基于ADAR的RNA编辑器的希望。他们各自开发出将指导RNA与ADAR酶相连的系统。这些系统都依靠ADAR能够将RNA编码中的腺苷(A)转变为肌苷(I)的天然能力。当细胞使用编辑过的RNA来制造蛋白时,它们会把不常见的肌苷(I)解释为鸟苷(G)。这一编辑的最终结果是将编码中的A变为G。他们的研究分别在2012年和2013年发表在《Angewandte Chemie International Edition》和《PNAS》杂志上。
然而,当他们的研究发布时,CRISPR基因编辑系统已经出现了,CRISPR系统简便有效地编辑DNA的能力吸引了大多数人的目光。编辑RNA的研究并没有引起人们的重视。然而,Stafforst和Rosenthal博士仍然继续进行优化RNA编辑器的工作。对于他们来说,RNA编辑器仍然具有独特的优势。例如,CRISPR系统的一个缺陷是它可能导致脱靶效应,在DNA上的脱靶效应会导致DNA编码的永久改变,而RNA编辑的脱靶效应是暂时的,这意味着RNA编辑可能是一条更安全的治疗途径。
在2017年,张锋博士开发出他自己的RNA编辑器,他的团队将ADAR的催化部分与一个Cas蛋白相结合,使用指导RNA引导对特定RNA序列的单碱基编辑。这项研究发表在《科学》杂志上。随后,他与David Liu等人联合创建了Beam Therapeutics公司。张锋博士的研究让人们重新开始关注RNA编辑领域。除了Beam以外,一家名为Locana的初创公司也在开发基于Cas酶的RNA编辑系统。
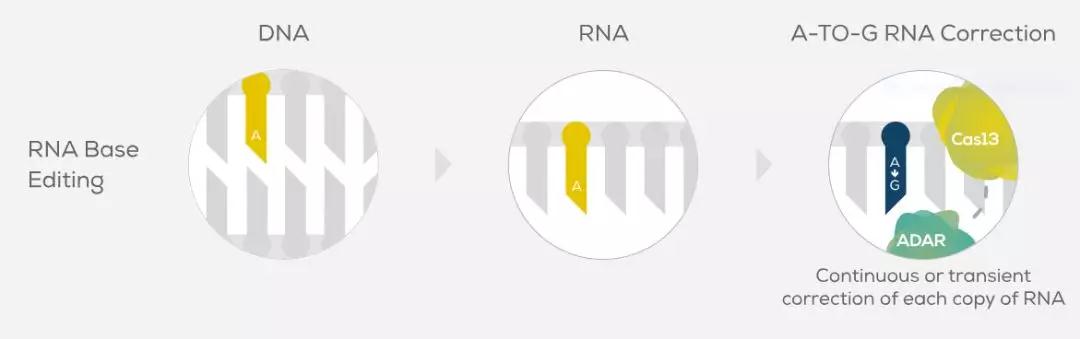
▲基于Cas13的RNA单碱基编辑系统(图片来源:Beam Therapeutics官网)
将ADAR酶与Cas酶相结合开发的RNA编辑系统可能帮助ADAR酶更精准地与特定RNA序列相结合,从而减少RNA编辑的脱靶效应,这是RNA编辑器开发的一个方向。而研究人员开发的另一个方向是不使用Cas酶,通过对指导RNA序列进行改造和优化,进一步精简RNA编辑系统,让它们更容易转化为疗法。
以前,不同类型的RNA编辑器都需要将ADAR酶和指导RNA同时引入细胞中,从药物递送的角度来说,这是一个非常严峻的挑战。即便在CRISPR基因编辑领域,如何安全有效地递送Cas9和指导RNA仍然是未被完全解决的重大挑战。在今年1月,Stafforst博士在《Nature Biotechnology》杂志上发表的研究表明,通过对指导RNA进行化学修饰,研究人员可以在指导RNA中添加特定结构,让它们能够利用人体细胞中已经存在的ADAR蛋白进行RNA编辑。

今年2月,加州大学圣地亚哥分校的Prashant Mali博士在《Nature Methods》上发表的研究再度验证,只使用改造过的指导RNA,就可以与ADAR结合并且将它带到正确RNA序列,在小鼠模型中修复与肌营养不良症和鸟氨酸转氨甲酰酶缺乏症相关的RNA基因变异。Mali博士也创建了一家名为Shape Therapeutics的公司来开发RNA编辑疗法。
Stafforst和Mali博士的最新研究体现了RNA编辑与CRISPR基因编辑相比的两个重要优势:
一,只使用指导RNA来利用人体自身的ADAR酶进行RNA编辑,不需要将外源蛋白引入体内,从而避免CRISPR系统需要解决的潜在风险,因为Cas蛋白来自细菌,它可能引发人体免疫系统的反应。
二,化学合成的指导RNA的特性与反义寡核苷酸相同,这是一类已经被证明可以用于治疗大脑,眼科和肝脏疾病的药物模式。
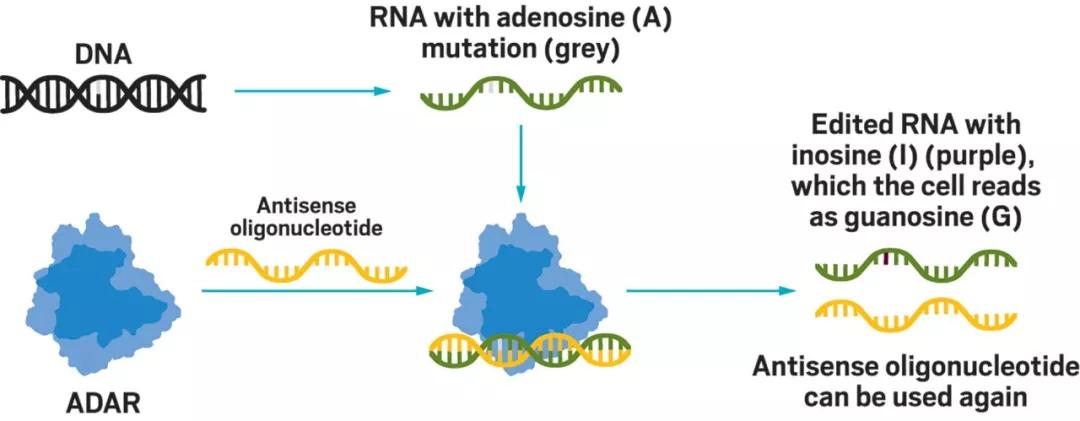
▲使用反义寡核苷酸引导ADAR进行RNA编辑(图片来源:ProQR Therapeutics官网)
“反义寡核苷酸的一个优势是它们已经经过了几十年的研究。”ProQR Therapeutics公司的首席执行官Daniel de Boer先生说。这家成立于2014年的生物技术公司一直在设计反义寡核苷酸,募集人体中天然的ADAR进行RNA编辑。该公司的研发管线中的主打疗法将用于治疗10型Leber先天性黑朦(一种遗传性眼科疾病)和亚瑟综合症(一种听觉和视觉障碍)。
RNA编辑领域也在吸引更多学术界的投入。今年1月,雷特综合征研究信托基金(Rett Syndrom Research Trust, RSRT)授予多家学术实验室500万美元,开发治疗雷特综合征的RNA编辑疗法。雷特综合征是由于基因突变,导致名为MeCP2的蛋白水平不足。RNA编辑可能帮助修复产生蛋白的蓝图。
对于像雷特综合征这样的遗传病来说,RNA编辑疗法需要重复给患者施药,而基因疗法和基因编辑疗法可能达到一劳永逸的治疗效果。然而,在细胞中产生适量的 MeCP蛋白非常重要,不能太多,也不能太少,俄勒冈健康与科学大学(Oregon Health and Science University)的Gail Mandel博士说。将转基因引入体内的基因疗法可能有生成过多MeCP2的风险,RNA和DNA编辑疗法可以避开这一风险。
其它研究团队已经开始探索RNA编辑作为暂时疗法的潜力。例如,Stafforst博士指出,RNA编辑可以用来增强或减弱炎症,从而帮助治疗癌症或免疫疾病。Rosenthal博士的实验室在设计能够降低痛觉受体敏感性的RNA编辑疗法。如果这项研究获得成功,它可能带来一种疗效持续几天或几周的止痛剂,它不会上瘾,而且疗效是可逆的。
目前RNA编辑疗法还不完美。“然而,一旦你能够跨越这一挑战,它将带来无数的治疗机会。”Stafforst博士说。RNA编辑虽然还是一个小的领域,但是他相信在未来的几年里,随着更多的研究人员从DNA编辑转向RNA编辑,这一技术的更多应用将会出现。
参考资料:
[1] Watch out, CRISPR. The RNA editing race is on. Retrieved March 28, 2019
[2] Beam Therapeutics. Retrieved March 29, 2019
[3] ProQR Therapeutics. Retrieved March 29, 2019
[4] Cox et al., (2017). RNA editing with CRISPR-Cas13. Science, DOI: 10.1126/science.aaq0180