本文转载自“新浪医药”。
全球知名医药市场调研机构EvaluatePharma近日发文,对2019年度即将进行上市的重磅药物进行了分析。正如卖方分析师所预测的,Alexion公司重磅孤儿药Soliris的升级版产品Ultomiris有望成为今年推出的最具商业潜力的新产品,该药已于2018年12月获得美国FDA批准,预计2024年的销售额将达到34亿美元。
与此同时,美国FDA“停摆”已经影响到了正在进行中的新药审查,而关于这方面的任何更新,都将受到艾伯维、诺华、强生等公司的密切关注。这些公司都迫切希望各自的潜在重磅药物能够在2019年的头几个月里赢得监管批准。而对于那些在最近提交申请的制药公司来说,FDA停摆会造成什么,目前还不清楚。
基于EvaluatePharma的共识预测以及卖方预测,2019年将进行上市的TOP10重磅产品清单如下表所示:
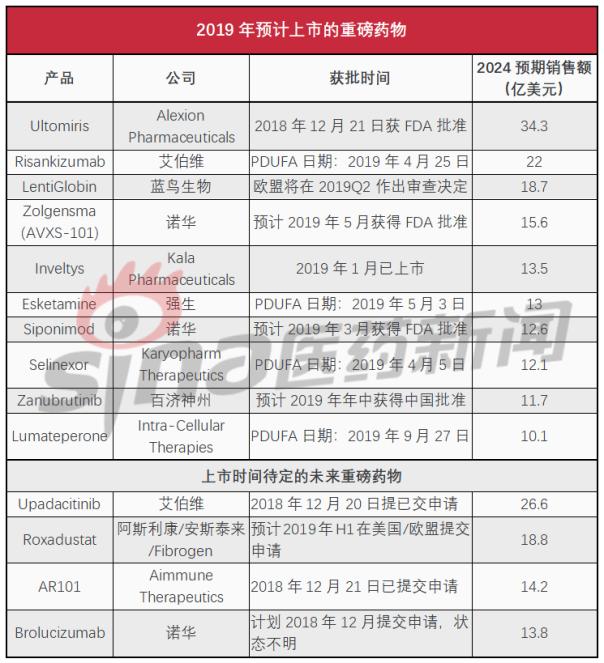
Alexion公司药物Ultomiris比预期提前2个月获得FDA批准,该产品的上市将成为2019年的重头戏,特别是考虑到FDA在过去一年里创记录的批准了61个新药,其中大多数(31个,占比51%)针对的都是罕见性疾病领域。
上述列表中,Kala公司用于治疗眼科术后炎症和疼痛的新型纳米制剂Inveltys(氯替泼诺混悬滴眼液,1%)已于上周登陆美国市场,卖方预测该药2024年销售额将达到13.5亿美元,不过该公司市值仅为2.15亿美元,投资者显然不持同样的乐观态度。
除了这两个药物之外,上述列表中的其他药物目前仍在接受监管审查。而在美国,由于政府持续关停,批准时间表远不如前几年那样确定。另外,有4个药物在2018年底或即将提交申请,这些药物在2019年的情况如何到目前为止仍然是未知数。
艾伯维希望能够在今年推出类风湿关节炎新药upadacitinib,不过该公司尚未透露FDA是否已经接受其新药申请,而诺华此前曾表示在2018年12月提交其黄斑变性眼科产品brolucizumab的申请,目前尚不清楚这2家公司是否在政府关停之前就成功了。
专注过敏免疫疗法的Aimmune公司告诉投资者,该公司在政府关停前已经提交花生过敏疗法AR101的上市申请,目前还处于悬而未决的阶段,尽管该公司在tweet(推特)上向FDA局长Scott Gottlieb发送了一条消息,询问实际情况。但Scott Gottlieb指出,诸如AR101这类的过敏性产品不包括在用户收费法项目内,因此FDA在关停期间没有资金继续推进审查。
但不论情况如何,upadacitinib、brolucizumab、AR101这3个药物都将在2019年启动审查。另一个是阿斯利康的roxadustat,部分卖方分析师预计该药也有希望能够在2019年登陆美国市场,尽管目前看来还是一个很长远的目标。
值得注意的是,许多卖方分析师认为,在2019年,来自新基的多发性硬化症药物ozanimod和CAR-T疗法JCAR17(liso-cel)也有可能上市。但EvaluatePharma认为,JCAR17在2019年获得监管批准几乎是不可能的。至于ozanimod,该药之前已被FDA拒绝,目前还未重新提交申请,而且这两个药物都受到百时美施贵宝谈判的或有价值权(CVR)约束,新基只有在2020年前将两个产品推向市场才能得到回报。有分析师认为,百时美施贵宝几乎没有动力来加速这两个产品上市。
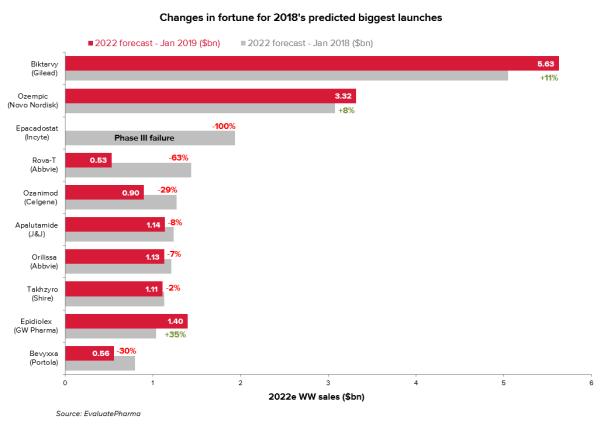
从对2018年最有希望上市的TOP10重磅药物回顾来看,即使这些项目备受瞩目,也不一定就能免于挫折。Incyte公司免疫肿瘤学项目epacadostat可以说是2018年最悲剧的新药项目,现在看来进入市场的机会已经非常渺茫。同样的,艾伯维的抗体药物偶联物Rova-T看起来注定也将被废弃。
2019年预计上市的TOP10重磅产品中,大多数已处于监管审查阶段。但如果发生了无法预料的数据或技术问题,这些产品也有可能会遭遇epacadostat或Rova-T的境遇,这一点谁也无法保证。(新浪医药编译/newborn)
文章参考来源:As the US shutdown rolls on, blockbuster launches line up for 2019







