本文转载自“药渡”。
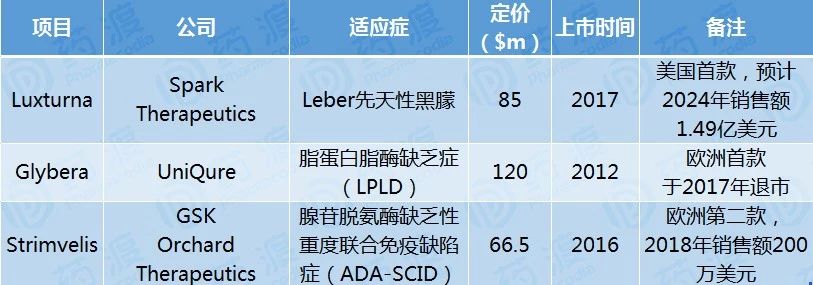
从表格中看出,三款热点基因疗法定价在100万美元左右。Glybera上市几年因销售额惨淡而于2017年退市,120万美元的定价估计有太多患者望洋兴叹,也为后面“有价无市“埋下了隐患,作为欧盟首款获批的基因疗法,这样的表率还真衰。Luxturna定价88万美元,预计2024年销售额达到1.49亿美元,2018年初诺华以1.7亿美元高价获得美国以外的地区共同研发和推广权益。诺华在基因疗法领域的投入真是慷慨,2018年4月还又以87亿美元收购AveXis,获得AAV9基因疗法AVXS-101,不亏是首款CAR-T Kymriah的推动者,可AVXS-101定价一公布,瞬间引发爆点,诺华押宝是否正确暂且不论,渗透率如何我们也拭目以待,400-500万美元真扛不住,就算以后能入医保,价格也远高于LentiGlobin的约55万美元。与以上两款相比,Strimvelis定价并不高,不过2018年也做到了200万美元的销售额。
近期Evaluate Pharma也就“高定价、小容量”策略在多个方面进行了讨论,从患者数量出发,预测了现处于研发阶段,将在2024年销量位居Top10的基因疗法,具体见下表所示。
这与之前预测的全球销售额Top10大同小异。最大的亮点在于HMI-102,目前还处于IND阶段,计划于2019年启动一/二期临床研究。2018年3月Homology Medicines凭借“同源重组,无需CRISPR-Cas9等外源系统“的优势登陆纳斯达克,其产品HMI-102的身价也因此水涨船高,进入Top10。除此之外,这些项目大部分处于中晚期阶段,有两款已进入BLA,分别是蓝鸟生物的LentiGlobin和诺华的AVXS-001,两者净现值(NPV)最高,LentiGlobin携两适应症入榜。针对A型血友病有两款,其中Spark的valoctocogene roxaparvovec与SPK-8011相比,在销售额和净现值上都略胜一筹,其实两种疗法机理类似,均是使用AAV载体将FVIII(凝血因子VIII)基因的功能性拷贝转移到患者体内,但根据目前数据显示,valoctocogene roxaparvovec发展较快已进入三期,且临床数据更加具有吸引性。针对B型血友病的基因疗法AMT-061上榜,但同是该领域领跑者的Spark,其与辉瑞合作开发的SPK-9001却落榜,两者现均处于临床三期,但AMT-061使用FIX-Padua取代野生型FIX,FIX活性水平可大大提高,有望成为首个进入市场的B型血友病基因疗法,抢得先机,身价自然不同。治疗杜氏肌营养不良(DMD)的有两款,SGT-001和AAVrh74.MHCK7.Micro-Dystrophin,两者预测的2024年销售额差不多,NPV却相差2.5倍多。基因疗法的先锋Spark占两款,针对无脉络膜症和A型血友病。接下来分别介绍这十款将在2024年畅销的在研基因疗法以及相应的适应症。
1LentiGlobin
LentiGlobin是蓝鸟生物研发的一种β珠蛋白基因疗法,曾提交上市申请,用于治疗β-地中海贫血和镰刀型细胞贫血症,已获美国FDA和欧盟EMA认证的治疗镰刀状贫血症孤儿药。
β-地中海贫血是我国南方各省最常见、危害最大的血液遗传病,人群发生率高达10%以上,以广东、广西为主。因基因突变程度不同,地中海贫血表现多样,一般分为轻型、中间型和重型。据统计,中国的重症地贫患者约30万,而全球的患者以6万/年的速度增长。2018年12月,LentiGlobin的临床一/二期研究Northstar(HGB-204)结果于ASH会议公布,使用LentiGlobin治疗的10名TDT和非β0/β0基因型患者中有8名实现了输血非依赖性(transfusion independence),截至2018年9月14日,这8名患者维持输血非依赖性,中位持续时间为38个月(21-44个月),总血红蛋白水平稳定,在最后一次研究随访时为9.7-14.1g/dL。使用LentiGlobin治疗TDT的成人和青少年患者的安全性通常与骨髓清除性预处理一致。血小板移植的中位时间为39.5(19-191)天。
2AAVrh74.MHCK7.Micro-Dystrophin
杜氏肌营养不良症(DMD)是一种毁灭性的肌肉疾病,由X染色体上的抗肌萎缩蛋白基因突变引起,特征是进行性肌肉退化和萎缩,导致心肌病和呼吸衰竭而过早死亡。据估计,平均每5000名男婴就有1人受到影响,美国约有1.5万名男孩患有DMD,全世界估计有30万名患者。
rAAVrh74.MCK.Micro-Dystrophin是Nationwide Children's Hospital和Sarepta Therapeutics合作开发针对DMD的一种基因疗法,目前处于治疗DMD的临床一/二期研究。由于质粒制造问题,FDA此前曾叫停该项临床试验,但现在已经放行,预计很快会继续开展。
3SGT-001
SGT-001是Solid Biosciences研发的一种将转染了含有功能性肌营养不良蛋白基因(合成的dystrophin基因,亦称为microdystrophin)的腺相关病毒AAV9载体,递送到患者肌肉细胞中的基因疗法,治疗DMD已获FDA和EMA授予的孤儿药资格,及美国的快速通道资格,目前处于临床一/二期研究试验阶段。
2018年2月14日,在其临床试验中,患者开始使用SGT-001,可几天后,患者因血小板计数减少,随后红细胞计数减少和补体激活住院。Solid Biosciences将这一意外事件归类为疑似意外严重不良反应( SUSAR),并将其报告给FDA,而后试验被暂停。2018年6月,在Solid公司满意地解答了所有临床问题之后,FDA取消了对IGNITE DMD项目的临床试验暂停控制。目前Solid已经开始恢复其临床试验活动,并有望在2019年下半年提供中期分析数据。
SGT-001最初由密苏里大学哥伦比亚分校开发,然后授权给Solid GT(Solid Biosciences的子公司)。
2016年6月,Solid Biosciences与三家慈善机构Duchenne Now,Fight DMD和Save Our Sons达成合作协议,支持该公司治疗杜氏肌营养不良症的计划。2016年10月,Solid Biosciences获得Alex's Wish和Duchenne Now慈善机构的资助,以支持公司的基因治疗计划,与佛罗里达大学合作开发和改进基因疗法的生产技术。2017年9月,Solid Biosciences与Synpromics签署研究和开发协议。
4AVXS-101
AVXS-101(Onasemnogene abeparvovec)是一种基于REGENXBIO公司NAV®基因输送技术平台开发的基因疗法,含递送人运动神经元生存蛋白(SMN)基因的腺相关病毒9型(AAV9)载体,可跨越血脑屏障直接递送至细胞,目前处于治疗脊髓性肌萎缩症的BLA阶段。
AVXS-101由AveXis原研,2016年全国儿童医院(Nationwide Children's Hospital)获得了该产品的合作研发授权。2018年诺华收购AveXis获得其权益。
5Valoctocogene roxaparvovec
A型血友病是FVIII缺乏所导致的出血性疾病,约占先天性出血性疾病的85%,发病率大约是B型血友病的4倍,是罕见病里一个相对有利可图的市场。目前全球患者超过15万名,中国的发病率约为10万分之3-4。
BMN-270(Valoctocogene roxaparvovec)是一种针对A型血友病的基因疗法,将含转染了凝血因子VIII基因的腺相关病毒载体送往患者的肝脏细胞,与目前的凝血因子VIII替代疗法相比,相对低水平的凝血因子VIII就具有临床疗效,微创性更强,不需要每周多次静脉内注射。
BMN-270最初由伦敦大学学院(UCL)和St Jude儿童研究医院研发,BioMarin于2013年获得研发权益,成为第一家为A型血友病开发基因治疗的公司。该药用于治疗A型血友病,已在美国获得孤儿药和突破性疗法资格,也已获得而欧盟PRIME资格,目前最高处于临床三期试验阶段。
在其GENEr8-1临床一/二期试验中,共40名A型血友病患者,在6x10^13 vg/kg(载体基因组/公斤体重,vector genome/kg)组中,平均年出血率(ABR)降低了97%,在接受治疗后第二年患者没有自发性出血事件,截止治疗104周,患者凝血因子VIII的用量平均减少了96%,FVIII活性水平在59%的正常范围内,并且中值接近正常水平为46%;截止治疗52周,4x10^13 vg/kg 组结果显示,ABR降低了92%,FVIII用量平均减少了98%,FVIII活性水平为32%。试验期间药物耐受性良好,没有患者产生对外来凝血因子VIII的抑制,也没有患者退出临床试验。
BMN-270的两项临床三期试验也正在进行中,GENER8-2(NCT03392974)研究将评估确认4x10^13 vg/kg剂量研究药物的安全性和有效性,主要终点为52周中位FVIII活性水平的变化,安全性方面将研究身体对药物作出的反应,完成日期预计在2022年12月1日。GENER8-1(NCT03370913)研究将评估确认6x10^13 vg/kg剂量的BMN-270在美国和英国约130名重症A型血友病患者中研究药物的安全性、有效性以及对当前护理标准的优越性,预计将于2019年第一季度完成。
6AMT-061
B型血友病是由于缺乏必要的凝血因子IX(FIX)而造成的凝血功能障碍,发病率大约为3.5万分之一,低于A型血友病。AAV5-hFIXco-Padua(AMT-061)是由uniQure开发的一种针对B型血友病的基因疗法。这是一种血清型5的重组腺相关病毒载体(AAV5),由携带具有凝血因子IX的帕多瓦基因变体(FIX-Padua)的基因盒组成,曾经被EMA授予PRIME资格和孤儿药资格,被FDA授予突破疗法资格,正在进行三期临床试验,用于治疗重度或中度重度B型血友病。
7SPK-8011
SPK-8011由Spark基因疗法公司开发,是一种新型生物工程腺病毒(AAV)载体,包含被肝脏特异性启动子控制、经过密码子优化处理的人凝血因子VIII基因的AAV-LK03衣壳,用于治疗A型血友病,已获美国孤儿药和突破性疗法资格,目前处于临床一/二期试验阶段。
8HMI-102
苯丙酮尿症(Phenylketonuria,PKU)是一种造成苯丙氨酸(phenylalanine)在体内积累的罕见遗传病。由于有助于产生分解苯丙氨酸所需的酶的基因缺陷所致。PKU患者血液中高浓度苯丙氨酸会对其中枢神经系统造成不可逆损伤,使患者产生智力低下、自闭症、癫痫、运动障碍等临床症状。
HMI-102是Homology Medicines公司研发的一项针对苯丙酮尿症(PKU)的基因治疗,旨在恢复PKU的正常代谢途径,2018年5月18日公布的新数据显示其具有的治疗潜力,计划在成人PKU患者中启动1/2临床试验,已获美国FDA授予的孤儿药资格。
9SPK-7001
无脉络膜症(Choroideremia、CHM)是一种X染色体相关的IRDs,在青少年中表现为夜盲症和视野减少,并进行性的视野缩窄,CHM的特点是CHM基因的缺失或者突变,导致Rab escort 蛋白1的缺失,估计美国及欧洲5国有大约12500名男性患有此病。用于治疗CHM的SPK-7001已获得美国FDA和欧盟EMA认证孤儿药资格。该药最初由宾夕法尼亚大学与费城儿童医院合作开发,之后授权于Spark Therapeutics。目前SPK-7001已被推进到开放标签,剂量递增的临床一/二期试验中,以评估视网膜下给药治疗无脉络膜症的安全性和初步疗效,现有临床数据表明,SPK-7001耐受性较好,未见药物相关性副反应或严重不良反应。
10ABO-102
A型圣菲利波综合症(Sanfilippo Syndrome Type A),即黏多糖贮积症IIIA型(MPS IIIA)是一种罕见的常染色体隐性遗传疾病,影响体内所有细胞和器官,可导致儿童的神经认知能力衰退、失语、活动能力丧失及夭折。ABO-102是一种针对该疾病的以腺病毒相关的基因疗法。该品最初是由Nationwide Children's Hospital研发的,后来授权给Abeona Therapeutics,已获EMA的孤儿药和FDA的快速审批资格,目前处于临床一/二期研究中。Abeona Therapeutics在2017年第13届WORLDSymposium™溶酶体贮积疾病世界探讨会上公布的临床一/二期试验结果显示,ABO-102成功到达患者全身的目标组织,包括中枢神经系统,安全性、耐受性良好,可减少患者尿液中硫酸乙酰肝素和尿液中总GAG量,此外肝脾肿大以及认知功能的改善较好。
参考
1.Tiny populations up the ante for gene therapy pricing;
2. Gene therapy deal-making shows no signs of stopping;
3.Bluebird bio Presents Updated Data from Clinical Studies of LentiGlobin Gene Therapy in Transfusion-Dependent β-Thalassemia and Sickle Cell Disease at 60th Annual Meeting of the American Society of Hematology‘
4.Solid Bio宣布FDA解除SGT-001的临床试验暂停状态;
5. Amy Brown.Vantage_2019_Preview;
6.BioMarin Provides 2 Years of Clinical Data in 6e13 vg/kg Dose from Ongoing Phase 1/2 Study in Valoctocogene Roxaparvovec Gene Therapyfor Severe Hemophilia A at World Federation of Hemophilia 2018 World Congress;