@大通福克斯美国会诊中心(CMAA)译
“近期,美国食品药品监管局(FDA)首次批准CAR-T细胞疗法可治疗某种类型的大B细胞淋巴瘤。FDA批准Axicabtageneciloleucel对治疗非霍奇金淋巴瘤有着里程碑的意义,希望之城是目前唯一一家提供该药物和治疗的医学中心。
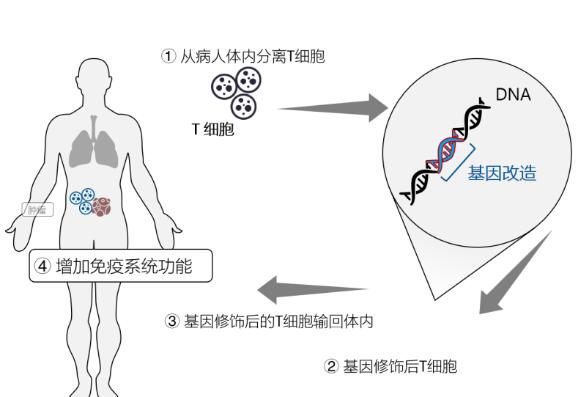
CAR-T治疗流程图
1、希望之城
希望之城是一所独立研究和治疗癌症、糖尿病和其他重大疾病的医疗中心,是美国49所综合癌症中心之一,受到美国国家癌症机构的最高认可。
位于美国加利福尼亚州的杜瓦迪市,在整个加州南部都设有社区诊所。它是美国国家综合癌症网络成员,拥有世界领先的研究项目和治疗方案。被“美国新闻和世界报道”评选为“全美最佳医院”。
成立于1913年,多年来在骨髓移植、糖尿病和癌症药物领域拥有突破性成果,引领着医学不断向前发展。
癌症中心将会成为美国首个提供Axicabtageneciloleucel的医疗机构之一,Axicabtageneciloleucel是一种治疗美国常见肿瘤的突破性药物。
2、CAR-T疗法的领军者
DUARTE, Calif.——希望之城是一所独立研究治疗癌症和糖尿病的医疗机构,享誉世界,也会成为全美第一批授权提供axicabtageneciloleucel药物的医疗中心。
CAR-T疗法是FDA批准的第二个基因疗法,也是第一个用于治疗非霍奇金淋巴瘤(NHL)的疗法。
Axicabtageneciloleucel由Kite Pharma制药公司生产,可以通过调节患者的T细胞来表达嵌合抗元受体(CAR),从而对抗体CD19进行靶向治疗。
CD19是一种存在于非霍奇金淋巴瘤、其他淋巴瘤和白血病患者体内细胞表面的蛋白质。CAR-T细胞治疗能够通过调节T细胞增强患者自身的免疫系统,达到识别和杀死癌细胞的目的。
希望之城技术总监、院长Steven T. Rosen, M.D.医生表示:“近二十年来,希望之城一直是CAR-T疗法的领军者。
对CAR-T疗法的研究也一直是我们多年来不断深入探索的课题,我们能够为世界各地的癌症患者提供最尖端的医疗服务。
如今,FDA批准Axicabtageneciloleucel对治疗非霍奇金淋巴瘤有着里程碑的意义,希望之城是目前唯一一家提供该药物和治疗的医学中心,旨在为该类患者提供最有效的治疗服务。”
3、希望之城CAR-T专项研究
希望之城对CAR-T的研究历史可追溯到20世纪90年代。从那时起,超过170位患者在希望之城接受了CAR-T治疗,同时也首次开展了对急性骨髓性白血病和恶性胶质瘤(一种恶性脑部肿瘤)的CAR-T治疗。
希望之城拥有世界上最具综合性的CAR-T细胞临床研究项目。目前有13项CAR-T临床试验正在进行,2018年计划另外开展8项相关研究,包括对多发性骨髓瘤、前列腺癌和乳腺癌的研究。
希望之城四年来不断发展和壮大细胞疗法。在骨髓和干细胞移植项目上一直处于世界领先地位,已有14,000例患者在希望之城接受了骨髓和干细胞移植。
希望之城结合了多个学科的医学团队包括:专业的内科医生、护士、重症专家、血液检查专家,共同研究骨髓和干细胞移植项目和CAR-T疗法。
“希望之城CAR-T疗法之所以如此成功是因为我们一直以患者关怀为宗旨,不仅仅治疗疾病,更是治疗患者。希望之城拥有经验丰富、专业背景深厚的医疗团队,能为患者提供最佳的axicabtageneciloleucel治疗,同时继续推进CAR-T治疗的临床试验以挽救更多的生命。”Francis&Kathleen McNamara血液学和造血细胞移植中心主席、血液恶性肿瘤和干细胞移植研究所负责人——Stephen J. Forman博士如是说。
4、非霍奇金淋巴瘤
淋巴瘤是最常见的血液肿瘤。被诊断为霍奇金淋巴瘤和非霍奇金淋巴瘤的患者占美国癌症患者人数的4%。其中60%的非霍奇金淋巴瘤为侵入性,常见的亚型有弥漫性大B细胞淋巴瘤。
美国癌症协会预估2017年将会有72,240例非霍奇金淋巴瘤患者。非霍奇金淋巴瘤,包括多种不同种类的亚型,都源于淋巴系统,在发作时两种白细胞——T细胞和B细胞也会出现异常。
该类疾病通常会出现一些疼痛性症状,如:淋巴结肿大、发热和疲劳等。难治性或治疗抑制性的入侵性非霍奇金淋巴瘤成长速度非常快。通常患者有50%的几率生存期可达六个月。
目前,对治疗有抑制反应的患者可以接受axicabtageneciloleucel治疗,这些患者包括对多种放化疗和骨髓干细胞移植治疗抑制的患者。
FDA批准axicabtageneciloleucel是根据ZUMA-1一期和二期试验数据。希望之城是全球四个进行ZUMA-1一期试验的中心之一。
在ZUMA-1二期试验中对101位患者进行试验,82%的患者接受单次注射药物后有很好的反应,这就表明这些患者在治疗后淋巴瘤有所改善。
8.7个月的随访后发现,44%的患者对治疗仍有反应,其中39%的患者淋巴瘤全部消失。所有参加试验的患者共计7,500名。
参考文献
https://www.cityofhope.org/news/kite-fda-approval







