
本文转自医药魔方数据微信,发布已获医药魔方授权,如需转载,请与医药魔方联系。
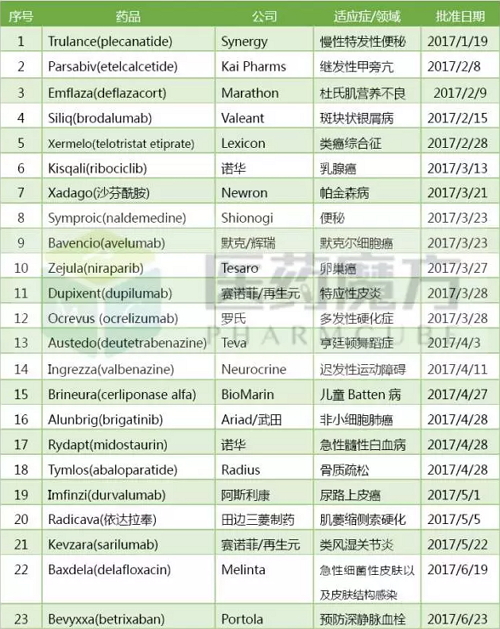
2017上半年FDA共批准23个新药,包括16个新分子实体和7个新生物制品。这个数字已经超过2016年全年批准的新药数量总和。近20年来批准新药数量最多的年份是2015年的45个,上半年批准了14个新药。如果按此趋势持续下去,2017年批准的新药数量将创下历史新高。
2017上半年FDA批准的新药
从市场潜力上看,赛诺菲/再生元在2017上半年获批上市了治疗特应性皮炎的dupilumab(IL-4Rα单抗)和治疗类风湿关节炎的sarilumab(IL-6R单抗)这两个单抗药物,成为最大赢家。EvaluatePharma预测dupilumab在2022年可以实现45亿美元的销售收入。
FDA上半年批准的最让人意外的新药是治疗肌萎缩侧索硬化的Radicava (依达拉奉)。这是一个率先在日本上市的药物,在没有美国临床试验数据支持的情况下,只凭借日本患者中的研究数据就获得FDA批准上市。
其他比较值得关注的新药包括阿斯利康的PD-L1单抗durvalumab,获批治疗晚期尿路上皮癌,是全球第5个上市的PD-1/PD-L1类药物,EvaluatePharma对其2022年销售额预测为20亿美元。罗氏ocrelizumab是首个获批可同时治疗复发缓解型多发性硬化症(RRMS)和原发性进展型多发性硬化症(PPMS)的药物。
下面对药物做一简单介绍:
1、Trulance(plecanatide)
Plecanatide是第一个尿鸟苷素类似物,由Synergy Pharmaceuticals开发,属于鸟苷酸环化酶-C(GC-C)激动剂,能够刺激肠液分泌,促进肠功能正常化和规律的排便。Trulance的批准剂量方案为口服3mg,每日1次,可在任何时间服用,不受进食影响。
慢性特发性便秘一种复杂的功能性胃肠道紊乱疾病,其症状包括每周少于3次的肠运动,肠梗阻等,病因及病理生理过程尚不明确。CIC影响约3300万美国人,占全球人口的14%。
在一项涉及2600例患者的大型III期、双盲、安慰剂对照研究中,与安慰剂相比,Trulance治疗12周,患者大便频率(每周自发排便次数),大便稠度(由布里斯托大便量表测量)有显著改善。Plecanatide最常见的不良反应是腹泻,禁用于6岁以下儿童。
2、Parsabiv(etelcalcetide)
肾功能减退、矿物质代谢紊乱可导致甲状旁腺分泌大量的甲状旁腺激素(PTH),引起继发性甲状旁腺功能亢进,这个疾病在透析患者中的发生率约为88%,在血液透析患者中的发生率为79%。
新型拟钙剂etelcalcetide可与甲状旁腺钙敏感受体结合并激活受体,继而降低PTH水平。因其可在血液透析后静脉给药,优于现有的标准拟钙剂治疗药西那卡塞。etelcalcetide在2月7日获批治疗成年血液透析患者的继发性甲状旁腺功能亢进,是12年来首个获批用于治疗透析患者继发性甲状旁腺功能亢进的药物。
在2项随机、双盲、III期对照试验中,1023例中重度继发性甲状旁腺功能亢进的血液透析患者(PTH > 400 pg/mL)除接受标准治疗(维生素D和/或磷酸盐结合剂)外,在透析(3次/周)结束时随机给予静脉注射etelcalcetide或安慰剂。
结果显示,治疗20~27周后,两项研究中etelcalcetide组患者PTH水平较基线值降低30%的患者比例分别为77%和79%,而安慰剂组则为11%和11%;etelcalcetide组PTH水平≤300 pg/mL的患者比分别为52%和56%,而安慰剂组患者仅为6%和5%。
3、Emflaza(deflazacort)
杜氏肌营养不良症(DMD)是一种X染色体隐性遗传疾病,由抗肌营养不良蛋白基因(dystrophin gene)突变所致,主要发生于男孩。全球平均每3500个新生男婴中就有一人罹患此病。患者在学龄前就会因骨骼肌不断退化出现肌肉无力或萎缩,导致不便行走。大部分DMD患者在3-5岁发病,7-12岁彻底丧失行走能力,20岁左右会因为心肌、肺肌无力死亡。
去年9月,FDA有条件批准了首个DMD药物Exondys 51(eteplirsen),适用于抗肌营养不良蛋白基因(dystrophin gene)中存在51号外显子跳跃(exon 51 skipping)的DMD患者,可以覆盖大约13%的DMD患者群体。
与Exondys 51不同,Emflaza适用于所有类型基因突变的DMD患者,用于5岁及以上DMD患者的治疗,是全球首个获批治疗DMD的皮质类固醇药物。
4、Siliq(brodalumab)
2月15日,FDA批准了Valeant制药的Siliq(brodalumab),用于对系统性疗法或光照疗法(紫外线治疗)不响应的成人中重度斑块状银屑病的治疗,属于二线用药。
Brodalumab是一种IL-17R抑制剂,能选择结合IL-17受体,阻止IL-17A、IL-17F及其它类型IL-17与受体的结合,是继诺华Secukinumab和礼来Ixekizumab之后FDA批准的第三个针对IL-17通路的单抗药物。
Brodalumab最初由安进研发,之后授权给了阿斯利康和日本协和发酵麒麟株式会社。2015年5月,临床数据显示brodalumab与患者自杀倾向相关,安进随之宣布终止与阿斯利康关于brodalumab的合作,放弃了对Brodalumab的开发。
阿斯利康在与安进分手3个月后,2015年9月将brodalumab以总计4.45亿美元的价格将brodalumab的全球独家开发和商业化权利(除了日本及其他一些亚洲国家,这些地区由协和发酵麒麟持有)授权给了Valeant。Siliq虽然成功上市,但带有警示自杀风险的黑框警告。
5、Xermelo(telotristatetiprate)
类癌瘤比较罕见且增长缓慢,大多发现于胃肠道。类癌瘤综合征在类癌瘤患者中的发生率不到10%,往往在肿瘤扩散至肝脏后才会发生。这些患者的肿瘤细胞会释放过多数量的血清素,从而导致腹泻。
无法控制的腹泻综合征将会导致患者体重下降、影响不良、脱水以及电解质紊乱等。在此情况下,生长抑素类似物能够抑制部分生长激素的分泌,缓解与功能性胃肠胰酶内分泌瘤有关的症状和体征,但其没有特异性,仅能对类癌瘤综合征的腹泻情况起到缓解作用,且容易引起患者体内的激素分泌水平。
FDA批准的Xermelo片剂与SSA联合,患者只需每日口服3次即可抑制血清素产生,减少类癌瘤综合征腹泻次数。
6、Kisqali(ribociclib)
FDA批准3月13日批准诺华Kisqali(ribociclib,LEE011)上市,联合芳香酶抑制剂一线治疗HR+/HER2-晚期或转移性乳腺癌。Kisqali以突破性药物和优先审评通道获得FDA批准,NDA的审评时间仅历时4.5个月。Kisqali是继辉瑞Ibrance(palbociclib)之后全球第2个上市的CDK4/6抑制剂。
在一项涉及668例绝经后HR+/HER2-晚期或转移性乳腺癌患者的III期MONALEESA-2研究中,中期分析时,ribociclib联合来曲唑作为一线疗法相比来曲唑单药治疗可以使疾病进展或死亡风险降低44%。Ribociclib+来曲唑中位PFS显著延长(19.3个月~未到达),来曲唑组为14.7个月(13.0~16.5个月)。继续随访11个月后,两组PFS分别为25.3和16.0个月。总生存期数据尚未获得。
7、Xadago(沙芬酰胺)
帕金森病是老年人中继阿尔茨海默氏病后第二大常见的慢性进行性神经变性疾病,全球大约700 ~1000 万例患者,其中 100 万例患者在美国。
帕金森病患者药物治疗后期会出现“开-关现象”。“开”是指药物对患者可以起到明显的治疗效果,病人能够运动;“关”是指患者运动能力丧失。“开-关现象”会随药物治疗时间的延长而愈发严重。生活中表现为病人突然变得僵硬不能运动,僵直持续几分钟,然后又突然能运动,随着病程的延长,这种状态持续时间越来越长,甚至僵直能长达数小时之久。
“开-关现象”与疾病本身的病情波动引起的运动障碍不同,是不可预知的,而且较多见于年龄偏小的帕金森病人。
FDA此次批准的 Xadago(沙芬酰胺)是作为一种辅助药物用于用于正接受左旋多巴 / 卡比多巴治疗并经历“关”期发作的患者。
8、Symproic(naldemedine)
FDA批准naldemedine用于治疗成人非癌性慢性疼痛患者服用阿片类药物引起的便秘(OIC)。Naldemedine是每日口服一次的外周作用μ阿片受体拮抗剂。
便秘是阿片类药物的最常见副作用之一。当阿片类药物与胃肠道中的阿片受体结合时,可能会诱发便秘。在慢性非癌性疼痛患者中,便秘患病率为40%~50%。
9、Bavencio(avelumab)
转移性默克尔细胞癌是一种罕见的侵袭性皮肤肿瘤,确诊后1年生存率低于50%,5年生存率低于20%。FDA在3月23日批准Bavencio(avelumab)20mg/ml注射液上市,用于治疗12岁以上青少年及成人转移性默克尔细胞癌患者。
Bavencio获得过FDA授予的突破性药物资格,此次是凭借应答率和应答持续期数据以优先审评的方式获得FDA加速批准,是全球第4个上市的PD-1/PD-L1类药物,也是第一个获批治疗转移性默克尔细胞癌的PD-L1单抗。
Avelumab的疗效和安全性在一项代号为JAVELINMerkel200的单臂、开放、多中心研究中得到证实。JAVELIN Merkel 200研究纳入88例经组织病理学确认且接受化疗后进展的转移性默克尔细胞癌患者,65%接受过一种疗法,35%接受过2种以上疗法,给予每2周1次avelumab 10mg/kg治疗,直至疾病进展或出现不可耐受毒性。
结果显示,总应答率为33%,其中11%为完全缓解,22%为部分缓解。产生应答的患者中,有86%可持续6个月以上,45%可持续12个月以上,应答持续期为2.8~23.3个月。最常见的不良反应包括疲劳(50%),骨骼及疼痛(32%),腹泻(23%),恶心(22%),注射部位反应(22%),疹(22%),食欲减退(20%)和外周性水肿(20%)。
10、Zejula(niraparib)
Niraparib是一种口服PARP抑制剂,主要针对的是BRCA1/2基因突变的癌症,开发用于卵巢癌和乳腺癌,此次获FDA批准上市,用于接收铂类药物治疗后完全应答或部分应答但又疾病复发的成人卵巢上皮癌、输卵管癌和原发性腹膜癌患者的维持治疗(延缓肿瘤生长)。据国立癌症研究所估计,美国2017年将有22000例上述新确诊癌症患者,14000例死亡患者。
2016年9月29日,再鼎医药与Tesaro达成战略合作协议,获得Niraparib在中国市场的独家研发和销售权,Tesaro保留可能参与Niraparib在中国共同销售的选择权。此外,Tesaro从再鼎医药获得两个新型的处于研发阶段的免疫肿瘤新药项目海外合作的选择权。
Zejula是FDA继续阿斯利康Lynparza(奥拉帕尼,2014/12/19)、Clovis Oncology公司Rubraca(rucaparib,2016/12/19)之后,FDA批准的第3个PARP抑制剂。
11、Dupixent(dupilumab)
特应性皮炎是一种常见的复发性、慢性炎性皮肤疾病,患者通常表现为以炎症和瘙痒为特点的慢性皮疹。中重度特应性皮炎患者通常全身绝大部位皮肤长满红疹,引发强烈持续的瘙痒、皮肤干燥、结痂、渗液,治疗药物非常有限。特应性皮炎影响1800万~2500万美国人,其中婴儿和儿童占8%~18%,大约30万成人亟需治疗药物。
dupilumab获得过突破性疗法资格,以优先审评方式获批,是FDA批准的首个治疗特应性皮炎的生物制品,EvaluatePharma预测2022年销售额可达45亿美元。
Dupixent是一种预填充注射器,患者在接受初始负荷剂量后,可自行给药,每2周1次,可以与局部用皮质甾体药物联用,也可以单独使用。禁用于对dupilumab过敏的患者。
FDA去年12月14日刚刚批准辉瑞花费52亿美元收购Anacor获得的小分子特应性皮炎药物Eucrisa(crisaborole,非甾体PDE4抑制剂),是15年来FDA批准的第一个治疗特应性皮炎的新分子实体,销售峰值预测可达20亿美元。
12、Ocrevus(ocrelizumab)
多发性硬化症(MS)是一种人体免疫系统异常攻击大脑、脊髓、视神经的神经细胞髓鞘而引起的慢性疾病,表现为肌肉虚弱、疲劳、视物困难,最终导致残疾。全球大约有230万例MS患者,目前尚无法完全治愈,包括复发缓解型多发性硬化症(RRMS,85%)和原发性进展性多发性硬化症(PPMS,15%)两种类型。
Ocrelizumab是选择性靶向CD20+ B细胞的人源单抗。CD20+B细被认为与髓鞘和轴突损伤有关,临床前研究结果显示,ocrelizumab可以选择性地与B细胞表面的CD20结合,而不影响干细胞或血浆细胞,可以发挥神经保护功能。
Ocrelizumab起始剂量为600mg,分2次给药,每周1次300mg,之后治疗剂量为600mg,每6个月1次。Ocrelizumab是目前为止最长效的MS治疗药物,也是首个获批可以治疗两种类型MS的药物。
Ocrelizumab由罗氏与Biogen合作开发,根据合作协议,ocrelizumab上市后,Biogen可从罗氏的销售收入中获得一定比例分成,其中美国市场的分成比例为13.5%~24%,美国以外市场为3%。
13、Austedo(deutetrabenazine)
deutetrabenazine是已上市亨廷顿药物四苯喹嗪的氘代产物,与原化合物相比,氘代后药代动力学特征得到改善,半衰期明显延长,从而可以降低治疗剂量。deutetrabenazine最初由Auspex公司开发,Teva在其III期临床数据发表后的4个月以32亿美元收购Auspex。
deutetrabenazine曾获得FDA授予的孤儿药资格,是FDA批准的第2个亨廷顿病药物,也是FDA批准的第一个氘代产品。
14、Ingrezza(valbenazine)
valbenazine是FDA批准的首个治疗迟发性运动障碍的药物。迟发性运动障碍是一种神经障碍,其特点是重复的不自主运动,通常是下巴、嘴唇和舌头,如扮鬼脸、伸出舌头及掴嘴唇。一些受影响的人也经历不自主的四肢运动或呼吸困难。
迟发性运动障碍是一种神经疾病,表现为舌、唇、口的异常不自主、缓慢不规则运动,以口周运动障碍最常见,包括转舌及伸舌运动、颌部咀嚼运动及撅嘴等。某些患者的躯干或四肢也会受到影响,或遭遇呼吸困难。
迟发性运动障碍通常是由吩噻嗪类及丁酰苯类药物所引起。口服普通抗精神病药发生率为20%~40%,使用长效抗精神病药发生率约50%。
Valbenazine的常见不良反应包括嗜睡、QT间期延长,禁用于先天性长QT间期综合征患者。服用Valbenazine的患者应避免驾驶或操作重型机械。
15、Brineura(cerliponase alfa)
Brineura是FDA批准的首个治疗晚发婴儿型神经元蜡样脂褐质沉积症(CLN2,又称儿童Batten病)的药物,以延缓3岁及以上症状性儿科患者行走能力的丧失。
Brineura是一种酶替代疗法,其活性成分(cerliponase alfa)是人类TPP1的重组形式,而CLN2病患者恰恰缺乏这一重要的酶蛋白。
Brineura在3岁以上儿科患者中的推荐剂量是300mg,每隔1周通过脑室内输注一次,然后输注电解质。完整的Brineura输液,包括所需的脑室内电解质输注持续约4.5小时。建议在开始输液前30至60分钟,预先施用抗组胺药物或皮质类固醇。
16、Alunbrig(brigatinib)
brigatinib被FDA加速批准用于治疗克唑替尼耐药后的ALK突变阳性NSCLC。在一项222例克唑替尼耐药患者中,brigatinib 90和180mg治疗组的总体应答率分别为48% vs 53%,其中完全缓解率分别为3.6%和4.5%。在基线有可测量脑转移病灶的患者中,90和180mg组颅内ORR分别为42%和67%。
brigatinib是FDA继辉瑞克唑替尼、诺华色瑞替尼、罗氏alectinib之后批准的第4个ALK+肺癌靶向药物。
17、Rydapt(midostaurin)
AML是一种快速进展的血液和骨髓肿瘤,发病率随年龄的增大而明显升高,中位发病年龄为66岁。在美国的AML中,适合接受骨髓移植的患者不足10%,而且大多数患者对化疗无响应并且会进展成复发或难治性AML,5年生存率大约20%~25%。根据美国癌症研究所的估计,2016年美国大约有19930例新确诊AML患者,10430例死亡AML患者。
FLT3突变是AML患者中一种常见的基因突变,与患者预后较差相关。midostaurin是一种口服多激酶抑制剂,可抑制多种调控细胞生长的关键激酶,包括Flt3,因此被开发用于携带FTL3突变的急性髓性白血病(AML)患者的治疗。midostaurin是首个用于治疗AML的靶向药物。FDA还批准Rydapt用于治疗罕见血液疾病(侵袭性全身性肥大细胞增多症)。
FDA曾授予midostaurin优先审评、快速通道(肥大细胞增多症)和突破性药物资格(AML)。一项代号为RATIFY的随机研究入组了717例初治AML患者,结果显示,与仅接受化疗的患者相比,Rydapt联合化疗可显著延长患者的生存期(74.7 vs 25.6个月)。
18、Tymlos(abaloparatide)
Abaloparatide是一种甲状旁腺激素相关蛋白(PTHrP)类似物,能与甲状旁腺受体1结合,从而起到调节代谢,促进骨骼形成的作用。在ACTIVE临床试验(18个月的数据)与ACTIVExtend临床试验(前6个月的数据)中,与安慰剂相比,abaloparatide能使新发椎体骨折风险降低86%,非椎体骨折风险降低43%。此外,新发椎体骨折与非椎体骨折的绝对风险也分别降低了3.6%和2.0%。
abaloparatide注射液上市被FDA批准用于治疗患有骨质疏松症风险的绝经后女性,是近15年来FDA批准的首个成骨类合成代谢药物。
19、Imfinzi(durvalumab)
durvalumab是全球第5个上市的PD-1/PD-L1类药物,是继罗氏、默克/辉瑞后第3个上市的PD-L1单抗。
在一项纳入了182例既往接受过铂类化疗后疾病进展的晚期或转移性尿路上皮癌患者的单臂临床试验中,给予每2周注射1次10mg durvalumab治疗,其总体客观缓解率到达了17%,在95名PD-L1阳性表达的患者中,总体缓解率为26.3%。正是基于这一积极的临床试验数据,FDA终极加速批准了这一药物,相较预期提前了6个月左右。
20、Radicava(依达拉奉)
依达拉奉是FDA自1995年以来批准的首个肌萎缩侧索硬化(ALS)新药。需要注意点是,依达拉奉于2015年首次被日本和韩国批准治疗ALS,FDA此次批准依达拉奉治疗ALS主要是基于在日本患者中进行的为期6个月的临床研究的结果。
ALS是一种罕见的未知病因的神经退行性疾病,该病患者身体中动用肌肉所必需的运动神经元被损坏,导致了像舌头、脖子和四肢之类里的所有肌肉的瘫痪。在美国,大约有12000-15000名ALS患者。这种疾病具有渐进的特性,患者的症状会不断恶化,大部分患者会在症状产生后的3到5年内会由于呼吸衰竭而死亡。
21、Kevzara(sarilumab)
sarilumab属于IL-6R单抗,原本在2016年底就应该上市,但由于现场检查发现了一些缺陷,一直延后到今年5月才被FDA批准上市。不过作为FDA在罗氏托珠单抗、强生司妥昔单抗之后批准的第3款IL-6/IL-6R靶向药物,大家对sarilumab也有很高的市场预期。
托珠单抗有静脉注射或皮下注射两种用药方式,每周用药1次,而 Sarilumab可以 每2周用药一次。sarilumab治疗类风湿关节炎的价格为每年 3.9 万美元,比起临床应用最广泛的两种 TNF 阻滞剂修美乐(阿达木单抗)和安进的依那西普 低大约1/3。
22、Baxdela(delafloxacin)
Delafloxacin是一种氟喹诺酮类抗生素,与其他喹酮类抗菌剂相比,对革兰氏阳性菌更有效,特别是对其他喹诺酮类抗菌剂耐药的甲氧西林耐药金黄色葡萄球菌(MRSA),此次FDA批准的剂型为300mg注射剂。
Delafloxacin的疗效得到了两个III期临床研究的支持。研究证明了静脉注射或口服delafloxacin的单药疗法在48~72小时早期临床反应的主要终点上不劣于万古霉素(vancomycin)和阿兹特龙(aztreonam)的结合疗法。
急性细菌性皮肤和皮肤结构感染是一个具有挑战性的医学难题。由于细菌对现有抗菌药物的耐药性提高,由耐甲氧西林金黄色葡萄球菌(MRSA)导致的发病率、并发症和住院率显着上升。
23、Bevyxxa(betrixaban)
betrixaban是每日一次的口服Xa因子抑制剂,是利伐沙班、阿哌沙班、依度沙班之后全球上市的第4个直接Xa因子抑制剂类抗凝血药。
FDA此次批准是基于随机、双盲、多中心、 APEX研究(NCT01583218)的数据,试验将 Betrixaban 延长治疗(35-42 天)与依诺肝素短期治疗(6-14 天)对急性住院患者 VTE 的预防效果进行了对比。有意思的是,尽管该研究未能到达主要终点(p=0.054),FDA仍给予了betrixaban上市许可。







