
5月22日,万众瞩目的“2017中国国际药物信息大会暨第九届DIA中国年会”在上海国际会议中心隆重开幕。本届年会以“恪守临床价值导向,引领药物研发新趋势”为主题,回归“临床价值”这一药物研发本质,夯实新药研发基础,促进高质量的新药开发,切实满足患者的需求。
从2009年至今,药物信息协会(DIA)与中国食品药品国际交流中心合作已经在中国成功举办了9届年会,是国内迄今唯一一家致力于传播药物信息知识的中立的国际交流平台。大会吸引来自各大洲及地区的2000多名药政法规,药物研发,健康产业的参会者,超过100个展位的形象展示,直击中国药物研发与法规创新带来的变革。
今年的DIA年设立了13个特色专题,囊括了“机遇与挑战并存的监管科学”、“纵览肿瘤药物开发的要点与热点”、“变革中的定量科学”“创新药物早期研发战略与战术”等热门议题。为顺应变革,会议还特别推出了“钻石经典分会研讨”与适合中小规模新型研发企业的“创新港展示”两大创新会议展览形式。
开幕式:恪守临床价值导向

5月22日是2017中国国际药物信息大会暨第九届DIA中国年会的第一天,也是正式开幕日。下午一点半,DIA中国区董事总经理朱立红代表DIA向全体参会嘉宾致谢,随后,DIA全球首席执行官Barbara Lopez Kunz女士、大会联席主席再鼎制药执行副总裁徐宁和中国食品药品国际交流中心薛斌主任先后致辞。




国家食品药品监督总局国际合作司袁林司长在致辞中对DIA在药物研发领域的工作予以积极肯定,本次DIA年会以“恪守临床价值导向、引领药物研发新趋势”为主题,以中国药品审评审批制度改革为背景而开展的一系列学术研讨与CFDA鼓励的创新、推动供给制度结构性改革的方向完全契合,从而更好地满足公众的用药需求,加快建设健康中国。

5月,CFDA以改革的名义,连发4份征求意见稿:
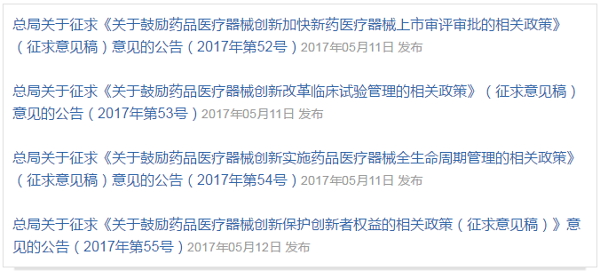
总局在公告中表示,发布这四份“征求意见稿”的目的在于“为进一步深化审评审批制度改革,促进药品医疗器械产业结构调整和技术创新,提高产业竞争力,满足公众临床需要”。“征求意见稿”将向社会公开征求意见。
5月23日下午,作为今年特设的DIAmond钻石经典分会的专场之一, CFDA专场将围绕以下主要内容展开:

按照惯例,主办方在5月21日举办了会前专题研讨会,共设有5个专题:新政策新形势下仿制药的产业升级、临床试验中风险管理的考量、数据流程核查、成为最懂统计的医学事务专家、CFDA/DIA 有关ICH的联合研讨会。
中国已提交有条件地加入ICH的申请
5个专题研讨会中,最令人关注的是由CFDA和DIA合办的CFDA/DIA有关ICH的联合研讨会。

CFDA国际合作司司长袁林回顾了近年来CFDA积极参与ICH 活动,对ICH相关一些国际标准的制定和修订做出极大贡献,并积极转化和借鉴ICH二十余部技术指南,成为中国技术审批的重要部分。CFDA通过一系列改革推动更安全有效的产品的上市,更好满足公众需求。他表示,中国加入ICH的时机基本成熟,已提交了有条件地加入ICH的申请。
演讲嘉宾与参会者共同探讨了技术指南最新进展、CFDA有关ICH技术指南和实施、制药工业界对加入ICH的期待以及在中国实施ICH的方向和展望。与会者表示在创新的世界大趋势下,中国参与ICH将加快创新药物的研发,有助于新药更快应用于临床而造福患者。
仿制药市场将向欧美靠拢
目前仿制药在我国上市药物中市场份额超过95%,是国家基本医疗保障制度的重要基础,而去年开始实施的仿制药一致性评价是众多药企面临的巨大挑战。因此,本次仿制药研讨会备受瞩目。

本次仿制药研讨会由江苏豪森药业的高级副总裁李元念博士担任主席,来自沈阳药科大学亦弘商学院的杨建红博士、辉瑞的刘萍博士,安必生制药的雷继峰、日本参天的稻垣孝司、FDA的Dale Conner博士、The Inspectors Network Consulting and Training Services的Alexander Honel、上海市食品药品检验所的杨永健博士、复旦大学药学院的李雪宁、苏州偶领生物医药的谢雨礼博士等多位中外专家先后做了发言。
临床试验需要进行风险管理
“临床试验中需要进行风险管理“专题讨论由北京人和广通的磨筱垚和阿斯利康的赵子贤博士负责组织。该研讨会针对临床研究设计和实施过程中如何进行风险管理进行探讨。
在临床研究实施中的风险管理包括如下方面:已知的基于风险的监察、评估、评价和缓解措施,新的安全信号的鉴别、评估和管理,对于紧急安全事件的管理以及临床试验中因新出现的风险而导致研究方案流程的更新。

成为最懂统计的医学事务专家
“成为最懂统计的医学事务专家”专题研讨会由勃林格殷格翰的陈小祥博士和李智、默沙东的郭翔博士和卫芳共同担任组委会成员。会中对于统计数据中如何鉴别统计偏差、假设检验、样本量估算等进行分享,将有助于医学事务人员发现研究设计中的不足,正确解读医学文献中统计问题。
数据流程核查

该专题由美达临床数据技术公司总经理孙华龙博士担任主席。数据库的质量和可信性是决定临床试验成功的关键,目前对于数据库搭建、编程和一些数据管理流程中还存在不足。数据流程核查专题对数据管理计划和如何在不同的电子数据采集系统中应用数据流程管理进行了分享。
关于DIA
DIA总部位于美国首都Washington DC,此外在北美、欧洲、日本、中国等设有分部。作为一家中立的国际组织,DIA 在制药和其它医疗健康领域,孜孜不倦50余年,为政府,工业和学术机构提供了形式多样的交流和学习的平台,赢得广泛认可和赞誉。备注:文章转自DIA中国官方微信号(DIA订阅号)







