突破性疗法认定(breakthrough therapy designation,BTD)由FDA于2012年7月创建,旨在加速开发及审查治疗严重的或威胁生命的疾病的新药,是继快速通道、加速批准、优先审评以后美国FDA的又一个新药评审通道。获突破性疗法认证的药物平均评审时间为 6.1 个月,相对于传统药物评审时间的 9-10 个月,时间缩短约1/3。
一般来说,BTD认定药物需满足两方面的要求:①单独或者与其他药物联合来治疗严重威胁患者生命安全的疾病;②在一个或多个重要的临床终点指标上,有充足的临床早期数据证明在研药物与现有治疗方式相比有根本性地突破。
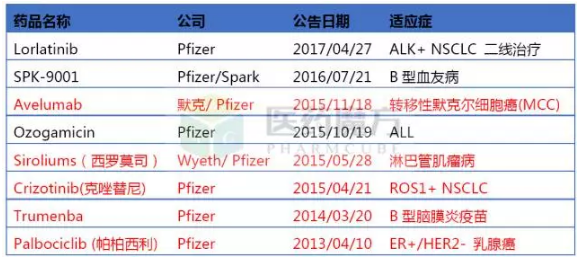
根据统计,从2012年7月至今共有178项申请获得FDA突破性疗法认定,目前已有154项已有相关企业公布。根据这些公开信息显示,罗氏、诺华、BMS、默沙东、辉瑞是获得突破性疗法最多的5家企业。
突破性疗法认定TOP5企业
备注:BTD认定按适应症统计
罗氏
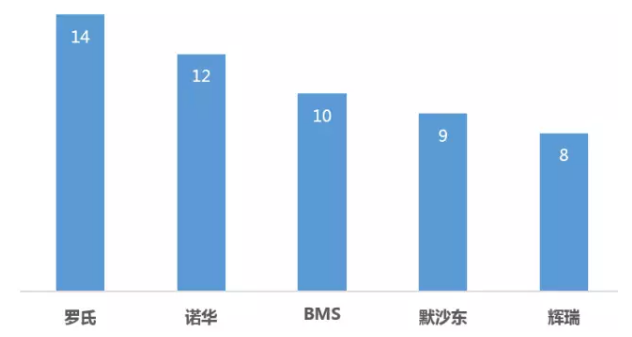
罗氏共有9个药物获得了14项突破性疗法认定,堪称“突破性疗法”最大赢家。其中有三项认定来源于公司与艾伯维合作药物Venetoclax。
罗氏获得BTD资格认定的药物
注:红色代表该BTD认定适应症已上市
Venetoclax是一种B细胞淋巴瘤因子-2(BCL-2)抑制剂,BCL-2在某些癌细胞中高度表达,可阻止细胞凋亡,与耐药性的形成相关。Venetoclax旨在选择性抑制BCL-2的功能,让癌细胞自我毁灭。Venetoclax在不到一年内获得了3项BTD认定,分别为17p缺失基因突变的CLL(慢性淋巴细胞白血病)二线治疗、Venetoclax联合罗氏利妥昔单抗治疗复发性/难治性慢性淋巴细胞白血病(R/R CLL)、联合去甲基化药物(HMAs)一线治疗不适合标准诱导治疗(高剂量化疗)急性髓性白血病(AML)。其中首项BTD认定适应症已于2016/4/11获得FDA批准。
阿来替尼是继辉瑞克唑替尼、诺华色瑞替尼后FDA批准的第3个ALK抑制剂。由中外制药研发,罗氏负责美国和欧洲市场的上市和销售,目前FDA已批准其用于不能耐受克唑替尼的ALK+NSCLC患者治疗,阿来替尼用于ALK+NSCLC一线治疗已获FDA突破性疗法认定。
另外罗氏潜在重磅炸弹药物Ocrelizumab、PD-L1单抗Atezolizumab都是率先通过BTD通道上市。
诺华
诺华突破性疗法认定收获最多的药物是Canakinumab,卡那单抗(canakinumab)是一种人源化单抗,通过选择性地与IL-1β结合,阻断IL-1β 与 IL-1 受体的相互作用,用于自身免疫性疾病的治疗。
诺华Ribociclib是继辉瑞Ibrance(palbociclib)之后全球第2个上市的CDK4/6抑制剂。在今年3月13日被FDA批准联合芳香酶抑制剂一线治疗HR+/HER2-晚期或转移性乳腺癌。Ribociclib以突破性药物和优先审评通道获得FDA批准,NDA的审评时间仅历时4.5个月。
诺华获得BTD资格认定的药物

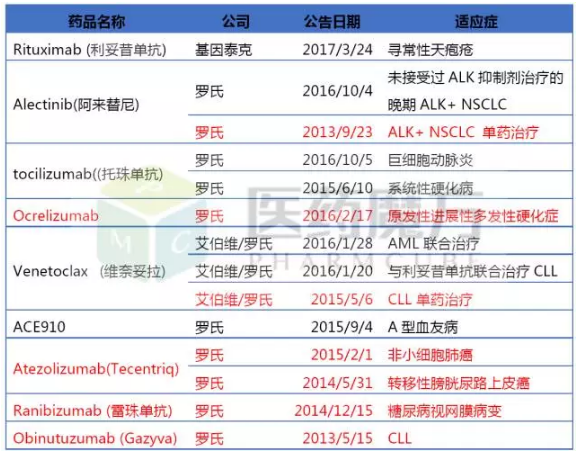
百时美施贵宝
百时美的10项BTD认定中,有6项来自其PD-1单抗Nivolumab,且这些突破性疗法适应症均已获批上市。
BMS获得BTD资格认定的药物
*:突破性药物资格被取消
默沙东
与BMS类似,默沙东此次入榜也是靠其PD-1单抗Pembrolizumab“撑腰”。Pembrolizumab迄今也获得了6项BTD认定,目前已有5项获批上市。
默沙东获得BTD资格认定的药物

*:突破性药物资格被取消
辉瑞
辉瑞和默克合作开发的Avelumab在2015/11/18获得BTD资格,2017/3/22FDA批准其用于默克細胞癌(MCC),这是第一个用于MCC的PD-1药物。Palbociclib 则是FDA批准的第一个CDK4/6抑制剂,2013年获得BTD认定,2015年被FDA批准上市,2016年销售额达21.35亿美元。
辉瑞获得BTD资格认定的药物